题目内容
【题目】甲、乙、丙三种固体物质的溶解度曲线如图所示,下列说法中正确的是( )
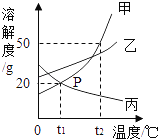
A.当甲物质中混有少量的丙时,可采取降温结晶的方法提纯甲
B.t1℃时三种物质的溶解度大小关系甲>乙>丙
C.升高温度可将丙的饱和溶液变成不饱和溶液
D.t2℃时甲的饱和溶液中溶质的质量分数为50%
【答案】A
【解析】
甲乙的溶解度随温度的升高而增大,甲的溶解度受温度影响比乙大;丙的溶解度随温度的升高而减小。
A、降温时,甲的溶解度减小,丙的溶解度增大,当甲物质中混有少量的丙时,可以用降温结晶的方法提纯甲,符合题意;
B、t1℃时三种物质的溶解度大小关系乙>丙=甲,不符合题意;
C、升高温度,丙的溶解度减小,丙的饱和溶液会析出晶体,不符合题意;
D、t2℃时甲的饱和溶液中溶质的质量分数为![]() ,小于50%,不符合题意。
,小于50%,不符合题意。
故选A。

【题目】实验室模拟工业炼铁的装置图如图所示。

(1)写出一氧化碳与氧化铁反应的化学方程式__________________。
(2)写出硬质玻璃管中的现象__________________。
(3)写出最右侧酒精灯的作用__________________。
【答案】Fe2O3+3CO![]() 2Fe+3CO2 红色粉末逐渐变黑 点燃尾气,防止CO污染空气
2Fe+3CO2 红色粉末逐渐变黑 点燃尾气,防止CO污染空气
【解析】
(1)由题意可知,在高温条件下,一氧化碳能与氧化铁反应,生成了铁和二氧化碳。反应的方程式是:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(2)由于氧化铁是红色的,生成的铁粉是黑色的。所以,硬质玻璃管中的现象是:红色粉末逐渐变黑;
(3)由于尾气中含有的一氧化碳有毒能污染空气。所以,最右侧酒精灯的作用是:点燃尾气,防止CO污染空气。
故答案为:Fe2O3+3CO![]() 2Fe+3CO2;红色粉末逐渐变黑;点燃尾气,防止CO污染空气。
2Fe+3CO2;红色粉末逐渐变黑;点燃尾气,防止CO污染空气。
【题型】实验题
【结束】
25
【题目】酸、碱、盐是几类重要的化合物,他们之间能发生复分解反应。
(1)复分解反应发生的条件是有沉淀析出,或有气体放出,或有____________生成。
(2)某化学小组进行“酸和碱的中和反应”实验:将盐酸滴入一定量的澄清石灰水中,实验无明显现象。取反应后的部分溶液加热、蒸干、得到白色固体。
以下是探究白色固体成分的实验,已知CaCl2溶液呈中性。请填写下表:
实验操作 | 测定结果 | 白色固体成分 |
用pH试纸测定反应后溶液的酸碱度,操作方法是_______ | pH>7 | __________ |
_______ | CaCl2 |
实验反思:无明显现象的中和反应可借助酸碱指示剂判断反应终点。
(3)“粗盐提纯”指除去NaCl中的泥沙和MgCl2、CaCl2、Na2SO4等杂质。某同学设计了除去三种可溶性杂质的实验方案:先将固体溶解,然后向其中依次加入过量的BaCl2、NaOH、Na2CO3溶液,充分反应后过滤,蒸发结晶。请回答:
①溶解、过滤和蒸发操作中都用到一种玻璃仪器是_______?该仪器在蒸发操作中的作用是_______?
②加入Na2CO3溶液的目的是______________?
③以上方案还需完善,请说明原因并加以补充_______。
(4)工业上常用NaOH溶液处理铝土矿(主要成分为Al2O3),反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O(杂质不参与反应也不溶于水)。若用160 kg NaOH配制的溶液恰好能处理340 kg铝土矿,最终得到1 004 kg NaAlO2溶液。计算:该铝土矿中Al2O3的质量分数_______。
【题目】硫酸铜溶液对过氧化氢的分解有催化作用,取一定质量8.5%的过氧化氢溶液倒入烧杯中,加入一定质量15%的硫酸铜溶液,过氧化氢完全分解,有关实验数据如表所示(不考虑气体在水中的溶解).请计算:
反应前 | 反应后 | ||
实验数据 | 烧杯和过氧化氢溶液的质量/g | 硫酸铜溶液的质量/g | 烧杯和烧杯中溶液的质量/g |
60 | 3.3 | 62.5 | |
(1)生成氧气的质量为________.
(2)反应后烧杯中溶液溶质的质量分数.(写出计算过程,结果精确到0.1%).