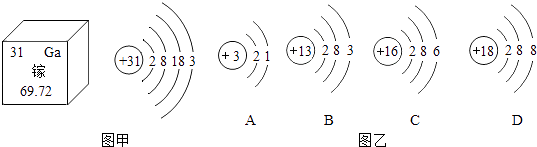
题目内容
【题目】甲、乙、丙三种固体的溶解度曲线如图所示,据图回答:①30℃时,丙的溶解度是; ②50℃时,在100g水中放入50g乙物质,充分搅拌后所得溶液的溶质质量分数为 . (计算结果保留至0.1%).
③若将20℃时甲、乙、丙三种物质的饱和溶液升温至40℃(不考虑水的蒸发),可析出晶体的是 .
④将50℃时甲、乙、丙三种物质的饱和溶液均降温至10℃,所得溶液的溶质质量分数从大到小的顺序是 . 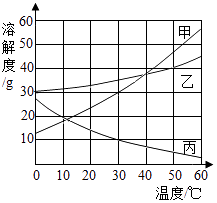
【答案】10g;28.6%;丙;乙>甲>丙
【解析】解:①据图可以看出,30℃时,丙的溶解度是10g,故填:10g;②50℃时,乙物质的溶解度是40g,在100g水中放入50g乙物质,充分搅拌后,只能溶解40g,故所得溶液的溶质质量分数为 ![]() ,故填:28.6%;③若将20℃时甲、乙、丙三种物质的饱和溶液升温至40℃,丙的溶解度随温度的升高而减小,故可析出晶体的是丙,故填:丙.④将50℃时甲、乙、丙三种物质的饱和溶液均降温至10℃,甲和乙都会析出晶体,形成的仍然是饱和溶液,且乙的溶解度大于甲,故乙溶液的溶质质量分数大于甲,而丙的溶解度随温度的降低而增大,溶液组成不变,据图可以看出,丙的溶质质量分数小于甲,故所得溶液的溶质质量分数从大到小的顺序是乙>甲>丙,故填:乙>甲>丙.
,故填:28.6%;③若将20℃时甲、乙、丙三种物质的饱和溶液升温至40℃,丙的溶解度随温度的升高而减小,故可析出晶体的是丙,故填:丙.④将50℃时甲、乙、丙三种物质的饱和溶液均降温至10℃,甲和乙都会析出晶体,形成的仍然是饱和溶液,且乙的溶解度大于甲,故乙溶液的溶质质量分数大于甲,而丙的溶解度随温度的降低而增大,溶液组成不变,据图可以看出,丙的溶质质量分数小于甲,故所得溶液的溶质质量分数从大到小的顺序是乙>甲>丙,故填:乙>甲>丙.
【考点精析】解答此题的关键在于理解固体溶解度曲线及其作用的相关知识,掌握1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和),以及对溶质的质量分数、溶解性和溶解度的关系的理解,了解溶质质量分数 =溶质质量/溶液质量*100% ;溶解度=溶质质量/溶剂质量*100g (必须选取饱和溶液);溶液质量=溶质质量(克)+溶剂质量(克) ;对于饱和溶液,溶液质量分数w = S/(S+100);所以溶解度S = 100/(1/w-1).

 名校课堂系列答案
名校课堂系列答案【题目】兴趣小组的同学发现,利用如图装置,可完成许多实验,请你回答下列问题: 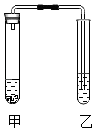
(1)【实验】
1 | 2 | 3 | |
甲(药品) | 浓氨水 | 碳酸钠、稀盐酸 | 水、氢氧化钠固体 |
乙(药品) | 无色酚酞溶液 | 澄清石灰水 | 水 |
现象 | 乙导管口有气泡冒出, | 乙导管口有气泡冒出 | |
结论和解释 | 分子具有的一条性质是 | 写出其中的一个化学方程式: | 出现该现象的原因是 |
(2)【交流与评价】 ①实验3中将氢氧化钠固体换成 , 原理一样,也会出现相同的现象.
②反应停止后将实验2中甲、乙两试管废液倒在一起,产生更多的沉淀,则反应停止后实验2甲试管溶液中的溶质是、 .