题目内容
【题目】科学探究是学习化学重要而有效的学习方式。某化学兴趣小组的同学以酸碱盐为专题进行 了以下几个探究实验。
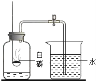
(1)为探究酸的化学性质,该小组做了下图所示实验。
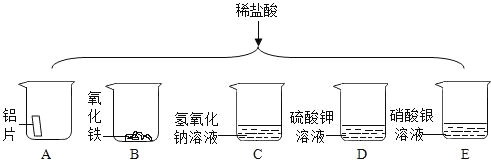
①一只烧杯反应后溶液呈黄色,写出所发生反应的化学方程式_____。
②下图是利用数字化传感器测得烧杯 C中溶液 pH的变化,下列说法不正确 的是(____)
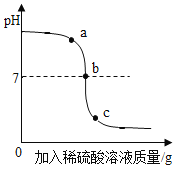
A 图中 a点所示溶液呈碱性
B 图中 b点反应的微观实质:H+ + OH-= H2O
C 图中 c点所示溶液中,含有的溶质是 NaCl和 NaOH
D 由a点到b点的 pH变化过程能证明酸和碱发生了反应
③D烧杯中的物质不与稀盐酸反应的原因是什么_____?
(2)尿素是一种重要的化学肥料,其化学式为 CO(NH2)2。工业上,可以在高温、高压的条件 下,以二氧化碳和 NH3为原料制得尿素并生成水。反应的化学方程式为_____。
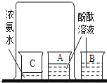
(3)食盐是一种重要的化工原料。粗盐中常含有少量的泥沙、CaCl2、MgSO4等杂质,将粗盐进行精制的流程如下图:
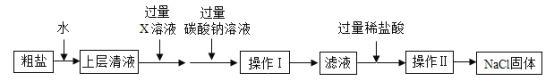
① 过量 X溶液中的溶质是_____。
② 操作Ⅱ中用到的仪器有铁架台、酒精灯、_____、玻璃棒。
③ 最后制得氯化钠的质量大于粗盐中氯化钠的质量,写出一个可使氯化钠质量增加的化学方程式_____。
(4)用50g稀盐酸与石灰石反应制取 CO2气体,恰好完全反应后,得到溶质质量分数为20%的 溶液55.5g,则该稀盐酸中溶质的质量分数是多少_____?
【答案】![]() C 不符合复分解反应发生的条件(合理均可)
C 不符合复分解反应发生的条件(合理均可)  氢氧化钡或Ba(OH)2 蒸发皿
氢氧化钡或Ba(OH)2 蒸发皿 ![]() 或
或![]() 14.6%
14.6%
【解析】
(1)①氧化铁和盐酸反应生成氯化铁和水,溶液变成黄色,反应的化学方程式:![]() ;
;
②A、图中a点所示溶液中,溶液的pH大于7,显碱性,故正确;
B、图中 b点PH=7,是因为氢氧化钠和稀盐酸恰好完全反应生成氯化钠和水,反应的微观实质:H+ + OH-= H2O,故正确;
C、图中c点所示溶液,pH小于7,溶液显酸性,说明盐酸过量,含有的溶质是 NaCl和 HCl,过错误;
D、由a到b点的pH值的变化是从大于7逐渐的减小到等于7,可以说明酸和碱发生了中和反应,故正确。
③盐酸和硫酸钾溶液既不生成沉淀或水,也没有生成气体,所以不会反应;
(2)在高温高压的条件下,以二氧化碳和NH3为原料制得尿素并生成水,反应的化学方程式为: ;
;
(3)① X溶液是氢氧化钡溶液,氢氧化钡和硫酸镁反应生成白色沉淀氢氧化镁、硫酸钡,可以除去硫酸镁;
② 操作Ⅱ是蒸发,用到的仪器有铁架台、酒精灯、蒸发皿、玻璃棒;
③最后制得氯化钠的质量大于粗盐中氯化钠的质量,是因为稀盐酸和氢氧化钠反应生成氯化钠和水,和碳酸钠反应生成氯化钠、水和二氧化碳,反应的化学方程式为:NaOH+HCl═NaCl+H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(4)设稀盐酸中氯化氢的质量为x,

![]()
x=7.3g,
稀盐酸溶液中溶质的质量分数为:![]() ×100%=14.6%。
×100%=14.6%。

【题目】根据下面溶解度表和溶解度曲线图回答问题。
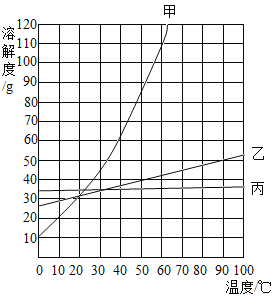
温度/℃ | 0 | 20 | 40 | 60 | 80 |
KNO3溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 |
(1)图中KNO3的溶解度曲线是_________________________。
(2)50℃时,乙的溶解度是_________________________。
(3)60℃时,将甲、乙、丙的固体各40g分别加入100g水中充分溶解后,能形成饱和溶液的是_________________________
【题目】探究氢氧化钠与二氧化碳的反应化学课上各小组的同学进行了如图所示实验:将二氧化碳通入氢氧化钠溶液中,没有观察到明显现象。
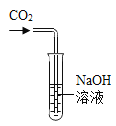
(定性实验)
(1)甲组同学为确定反应后所得溶液中溶质的成分,进行了如下探究:
实验步骤及现象 | 实验结论 |
______________________。 | 反应后溶液中的溶质为碳酸钠和氢氧化钠 |
(分离提纯)
(2)乙组同学欲从反应后所得的氢氧化钠和碳酸钠的混合液中提纯氢氧化钠固体,请将下表填写完整
选用的仪器名称 | 实验步骤 |
______________________。 | ______________________。 |
(定量实验)
(3)小组同学继续对一瓶长期放置的氢氧化钠固体的成分进行探究,利用化学沉淀法定量测量固体中氢氧化钠的含量,请你设计一套方案。你选择的反应原理是(用化学反应方程式表示)_______________________。
1试将实验操作流程补充完整(试剂任选),操作流程按下列图示表述:
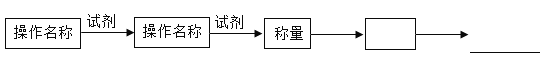
操作流程为:_______________________
2实验时称量样品的质量为a克,所测物质的质量为b克,则该试样中Na2CO3纯度的表达式为:___________________。
(反思交流)
(4)小组同学查阅了20℃时NaOH、Na2CO3在水中和乙醇中的溶解度
物质 | 20℃时的溶解度(g) | |
水 | 乙醇 | |
氢氧化钠 | 109 | 17.3 |
碳酸钠 | 21.8 | <0.01 |
经讨论,小组同学认为可以利用以上信息设计实验,通过观察明显现象证明CO2确实与NaOH发生了化学反应。他们的实验方案是_________________________________,实验过程中发生反应的化学方程式为________________________________________。