题目内容
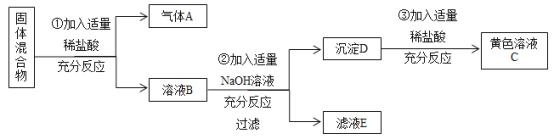
【题目】(1)二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺流程如下图:该工艺主要包括:

①粗盐精制(设粗盐含杂质为CaCl2、MgCl2):试剂X是____(填化学式);操作A的名称是____;加入适量HCl的目的是:既满足了电解时的微酸性,还能除去溶液中的杂质离子,请写出其中属于中和反应的化学方程式_____。
②电解微酸性NaCl溶液:请完成反应Ⅱ的化学方程式:NaCl+3____ NaClO3+3H2↑。
NaClO3+3H2↑。
(2)甲、乙、丙是初中常见物质,它们之间的转化关系如下图所示,其中部分反应物、生成物及反应条件已略去。

①若甲、乙、丙都是气体,丙是灭火剂,则乙是_____。
②若甲、乙、丙都为金属,反应皆是在溶液中进行的置换反应,甲、乙、丙三种金属的活动性从弱到强的顺序依次是_____。
③若甲、乙、丙含相同的金属元素。甲是可用于改良酸性土壤的碱,丙不溶于水。乙转化为丙的化学方程式是________(写一个)。
【答案】Na2CO3 过滤 ![]() H2O CO 甲>乙>丙
H2O CO 甲>乙>丙 ![]() (其他答案合理即可)
(其他答案合理即可)
【解析】
(1)粗盐中含有杂质CaCl2、MgCl2,向粗盐中加入过量氢氧化钠,氯化镁和氢氧化钠反应生成氯化钠和氢氧化镁,再加入过量碳酸钠,氯化钙和碳酸钠反应生成氯化钠和碳酸钙,过滤之后得到氢氧化镁和碳酸钙固体,和精盐水(主要含有氯化钠、氢氧化钠和碳酸钠);在精盐水中加入适量盐酸,盐酸和氢氧化钠反应生成氯化钠和水,盐酸和碳酸钠反应生成氯化钠、二氧化碳和水。
(1)①根据工艺流程图可知,粗盐中含有杂质CaCl2、MgCl2,向粗盐中加入过量氢氧化钠,氯化镁和氢氧化钠反应生成氯化钠和氢氧化镁,操作A之后得到碳酸钙,所以试剂X是碳酸钠,氯化钙和碳酸钠反应生成氯化钠和碳酸钙,操作A是过滤;精盐水中主要含有氯化钠、氢氧化钠和碳酸钠,加入适量盐酸,盐酸和氢氧化钠反应生成氯化钠和水,盐酸和碳酸钠反应生成氯化钠、二氧化碳和水,属于中和反应的化学方程式为:![]() ;
;
②根据质量守恒定律,生成物中含有1个Na,1个Cl,3个O,6个H,已知反应物中含有1个Na,1个Cl,则所缺物质中含有1个O,2个H,即为H2O;
(2)①若甲、乙、丙都是气体,丙是灭火剂,则丙是二氧化碳,那么甲是氧气,氧气和碳反应可以生成二氧化碳,氧气和碳反应也可以生成一氧化碳,则乙是一氧化碳,一氧化碳和氧气反应生成二氧化碳,故乙是CO;
②根据转化关系图可知,甲能够将乙和丙置换出来,所以甲的金属活动性大于乙和丙,乙能够将丙置换出来,所以乙的金属活动性大于丙,故甲、乙、丙三种金属的活动性从弱到强的顺序依次是甲>乙>丙;
③若甲、乙、丙含相同的金属元素。甲是可用于改良酸性土壤的碱,丙不溶于水,则甲是氢氧化钙,丙是碳酸钙,那么乙是氯化钙,氯化钙和碳酸钠反应生成氯化钠和碳酸钙,化学方程式为:![]() 。
。

【题目】下列四个图像中,能正确反映对应变化关系的是( )
A. 加热一定质量的高锰酸钾
加热一定质量的高锰酸钾
B. 向两份完全相同的稀盐酸中分别加入锌粉、镁粉
向两份完全相同的稀盐酸中分别加入锌粉、镁粉
C.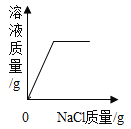 一定温度下,向氯化钠不饱和溶液中加入氯化钠
一定温度下,向氯化钠不饱和溶液中加入氯化钠
D. 将水通电电解一段时间
将水通电电解一段时间
【题目】“84”消毒液在新冠肺炎预防措施中使用较为广泛,其还具有漂白、杀菌、消毒的功效。某化学兴趣小组对 一瓶敞口久置的“84”消毒液的成分产生兴趣,在老师的指导下,展开探究。
已知:“84”消毒液和洁厕灵作用会产生氯气。
(提出问题)该敞口久置的消毒液中溶质有哪些?
(查阅资料)“84”消毒液的主要成分是次氯酸钠(NaClO)和氯化钠;NaClO 为有效成分,有腐蚀性并 易与空气中的 CO2 反应(2NaClO+CO2+H2O==2HClO+Na2CO3)。NaClO溶液、HClO都具有漂白、杀菌、消毒功效。HClO 不稳定,受热或光照条件下会发生分解。
(分析讨论)小组同学经过讨论,认为该消毒液中的溶质一定有____________________,可能还有 NaClO、Na2CO3、HClO中的一种或多种。
(实验探究)
实验操作 | 实验现象 | 实验结论 |
Ⅰ.向装入红色布条的试管中加入适量该消毒液 | 布条长时间不褪色 | 消毒液中不含___________ |
Ⅱ.另取少量该消毒液于试管中,滴入氯化钡溶液 | 白色沉淀 | 消毒液中含__________,发生反应的化学方程式为 ________ 。 |
(交流反思)生活中,“84”消毒液贮藏时应注意________________;一般不用“84”消毒液对蔬菜、水果进行消毒,其原因可能是________________。
(拓展延伸)
(1)次氯酸钠与稀硫酸可发生复分解反应,化学方程式为 __________________。
(2)“84”消毒液______(“能”或“不能”)与洁厕灵混合使用。