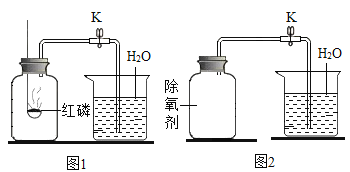
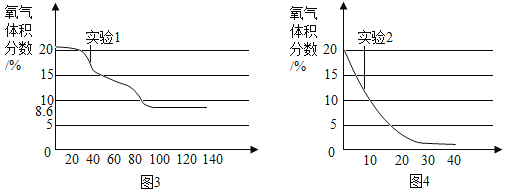
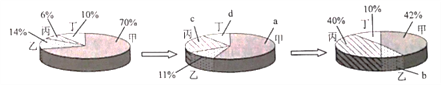
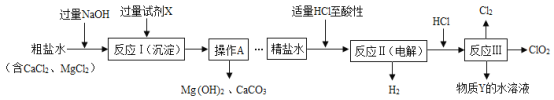
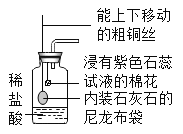
题目内容
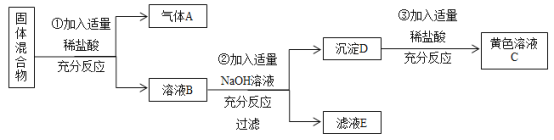
【题目】有某固体混合物,已知其中可能含有Na2CO3、CaCO3、CuSO4、FeCl3四种物质中的两种或多种。按下图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全反应),试根据实验过程和发生的现象填写以下空白:
(1)常温下,气体A水溶液的pH ____________7(填“大于”、“小于”或“等于”)。
(2)该固体混合物中,一定不存在的物质是_________________________(写化学式)。
(3)在滤液E中,一定大量存在的阴离子是(写离子符号)_________________________。
(4)写出过程③中一定发生反应的化学方程式 ____________________________。
(5)写出过程①中发生反应的一个化学方程式_____________________________。
【答案】小于 CuSO4 Cl- ![]()
![]() 或
或![]()
【解析】
固体混合物加入盐酸,产生气体,应该是碳酸钠或碳酸钙与稀盐酸反应生成了二氧化碳,故该气体一定是二氧化碳,可推出固体混合物中至少含碳酸钠、碳酸钙中的一种,向溶液B中加入适量氢氧化钠溶液,产生沉淀D,加入适量稀盐酸,产生黄色溶液C,可推出固体混合物中含氯化铁,氯化铁与氢氧化钠反应生成氢氧化铁,氢氧化铁与稀盐酸反应生成氯化铁和水,固体混合物中一定不含硫酸铜,因为硫酸铜与氢氧化钠反应生成氢氧化铜,氢氧化铜与稀盐酸反应生成氯化铜,氯化铜显蓝色。
(1)气体A为二氧化碳,常温下,二氧化碳与水反应生成碳酸,碳酸显酸性,pH小于7;
(2)由分析可知,该固体混合物中一定不含硫酸铜,化学式为:CuSO4;
(3)由分析可知,固体混合物中可能含碳酸钠、碳酸钙中至少一种,肯定含氯化铁,加入稀盐酸,碳酸钠与稀盐酸反应生成氯化钠、二氧化碳和水,碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,加入适量氢氧化钠,氢氧化钠与氯化铁反应生成氢氧化铁和氯化钠,故在滤液E中,一定存在氯化钠,可能存在氯化钙,故在滤液E中,一定大量存在的阴离子是:Cl-;
(4)由分析可知,步骤③为氢氧化铁与稀盐酸反应生成氯化铁和水,该反应的化学方程式为:![]() ;
;
(5)由分析可知,步骤①中可能是碳酸钠与稀盐酸反应生成氯化钠、二氧化碳和水,该反应的化学方程式为:![]() ;或碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,该反应的化学方程式为:
;或碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,该反应的化学方程式为:![]() 。
。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案