题目内容
【题目】化学是一门以实验为基础的科学,请结合图示回答问题:
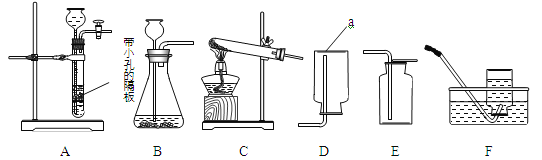
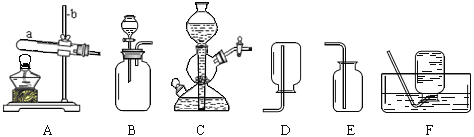
①写出仪器a的名称 (6) 。
②实验室用大理石和稀盐酸制取二氧化碳,发生反应的化学方程式为 (7) ;
通常不用碳酸钙粉末与稀盐酸反应制取CO2的原因是 (8) ;若要制取并收集一瓶CO2,且能使反应随关随停,选用的装置组合是 (9) (填字母);证明二氧化碳已收集满的方法是 (10) 。
③实验室用双氧水和二氧化锰粉末制取氧气时;在二氧化锰的催化作用下,过氧化氢迅速分解生成氧气和水,反应的化学方程式为 (11) 。哪些因素还影响着过氧化氢分解的速率?甲小组探究了溶质质量分数对过氧化氢分解的速率有影响,乙小组进行了更深入的探究:温度是否影响着过氧化氢分解的速率呢?
实 验 步 骤 | 现 象 | 结 论 |
取一支试管,加入5mL5%的过氧化氢溶液,然后把试管放入盛有冷水的烧杯中; | 缓慢有少量 气泡冒出 | (13) |
另取一支试管,加入 (12) , 然后把试管放入盛有热水的烧杯中。 | 迅速有大量 气泡冒出 |
④丙小组用装置C制取氧气,试管中固体的质量随加热时间变化的数据见下表。反应结束后,将剩余固体用适量水充分溶解后,过滤,回收二氧化锰固体,并得到氯化钾溶液100g。
加热时间/min | 0 | t1 | t2 | t3 |
固体质量/g | 28.0 | 23.2 | 18.4 | 18.4 |
(I)组装装置C时,下列仪器、用品的组装顺序是 (14) (填序号)。
a.试管 b.铁架台 c.酒精灯 d.木块
(II)共制得氧气的物质的量为 (15) mol。
(III)所得氯化钾溶液的溶质质量分数(根据化学方程式列式计算) (16) 。
【答案】(6)集气瓶 (7)CaCO3+2HCl===CaCl2+H2O+CO2↑ (8)反应快,不易控制
(9)A E (10)将燃着的木条放在集气瓶瓶口,火焰熄灭,则已收集满
(11)2H2O2![]() 2H2O+O2 ↑ (12)5mL5%的过氧化氢溶液
2H2O+O2 ↑ (12)5mL5%的过氧化氢溶液
(13)温度越高,过氧化氢分解的速率越快(或温度对过氧化氢分解的速率有影响)
(14)b d c a (15)0.3
【解析】
![]() 试题分析:(2)实验室用大理石和稀盐酸制取二氧化碳,生成的是氯化钙、水和二氧化碳:CaCO3+2HCl===CaCl2+H2O+CO2↑;由于碳酸钙粉末与稀盐酸反应的速率过快,不便于收集二氧化碳气体,故实验室不用它们来制取二氧化碳气体;实验室制取二氧化碳属固液在常温下的反应,由于B装置不能控制反应的发生和停止,故选A装置。A装置中将石灰石放在隔板上,然后往长颈漏斗中加稀盐酸,当需要反应停止时,关闭弹簧夹,稀盐酸进入长颈漏斗中,固体和液体分离,反应停止;二氧化碳的密度比空气大,易溶于水,只能用向上排空气法收集,验满的方法是将燃着的木条放在集气瓶瓶口,火焰熄灭,则已收集满;
试题分析:(2)实验室用大理石和稀盐酸制取二氧化碳,生成的是氯化钙、水和二氧化碳:CaCO3+2HCl===CaCl2+H2O+CO2↑;由于碳酸钙粉末与稀盐酸反应的速率过快,不便于收集二氧化碳气体,故实验室不用它们来制取二氧化碳气体;实验室制取二氧化碳属固液在常温下的反应,由于B装置不能控制反应的发生和停止,故选A装置。A装置中将石灰石放在隔板上,然后往长颈漏斗中加稀盐酸,当需要反应停止时,关闭弹簧夹,稀盐酸进入长颈漏斗中,固体和液体分离,反应停止;二氧化碳的密度比空气大,易溶于水,只能用向上排空气法收集,验满的方法是将燃着的木条放在集气瓶瓶口,火焰熄灭,则已收集满;
(3)过氧化氢分解生成的是水和氧气:2H2O2 ====== 2H2O+O2 ↑;探究温度对过氧化氢分解速率的影响应采用控制变量法,即温度不同,其他的条件要完全相同;通过反应的现象可知温度越高,过氧化氢的分解速率越快;
(4)装置C属固固加热型,组装的顺序是铁架台→木块→酒精灯→试管;
依据质量守恒定律化学反应前后物质的总质量不变,那么减少的质量即为生成的氧气的质量,
氧气的质量=28g-18.4g=9.6g
解:设反应生成氯化钾的物质的量为x,
2KClO3![]() 2KCl + 3O2↑
2KCl + 3O2↑
149 96
x 9.6g
149:x = 96:9.6g
x =14.9g
所得氯化钾溶液溶质质量分数为:14.9/100×100% == 14.9%
答:所得氯化钾溶液的溶质质量分数为14.9%。

 优学名师名题系列答案
优学名师名题系列答案