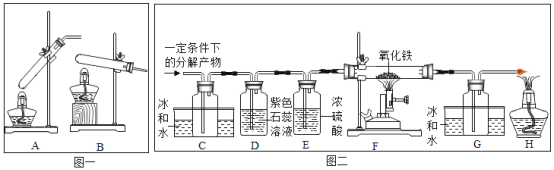
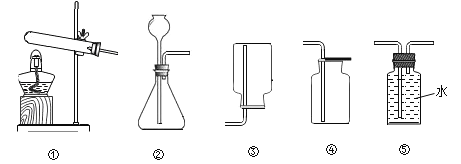
题目内容
【题目】某小组探究氢氧化钠和盐酸反应过程中pH的变化规律,得到如下图所示的曲线。则下列有关该实验事实的观点正确的是
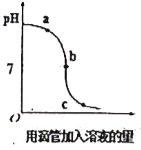
A.该实验是将氢氧化钠滴入到盐酸中
B.a点时的溶液不能使酚酞试液变色
C.b点表示盐酸和氢氧化钠恰好反应
D.c点时的溶液中的溶质只有氯化钠
【答案】C
【解析】
A、由图像可知,pH值是开始时大于7逐渐的减小到7然后小于7,可知原溶液显碱性,然后不断的加入酸性溶液,使pH减小,说明是把稀盐酸滴加到氢氧化钠溶液中,故A错误;
B、a点时溶液的pH大于7,溶液显碱性,能使酚酞试液变红色,故B错误;
C、b点时溶液的pH等于7,显中性,表示盐酸和氢氧化钠恰好反应,故C正确;
D、c点时溶液的pH小于7,溶液显酸性,说明稀盐酸过量,所得溶液中的溶质为HCl和NaCl,故D错误。故选C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目