题目内容
(2012?无锡)某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品(反应的化学方程式:2NaCl+2H2O
2NaOH+H2↑+Cl2↑),这种工业成为“氯碱工业”,某研究性学习小组对该厂生产的烧碱样品进行如下探究.
I.定性探究
【提出问题】烧碱样品中含有哪些杂质?
【猜想】猜想一:可能含有Na2CO3,作出此猜想的依据是
猜想二:可能含有NaCl,作出此猜想的依据是
【设计实验】
【交流与讨论】小明同学提出:“上述实验中稀硝酸也可以用稀盐酸代替”,你认为他的观点
II.定量探究
【提出问题】烧碱样品中氢氧化钠的质量分数是多少呢?
【设计实验】小婉同学设计探究方案后进行实验并测得数据如下:

请你利用小婉同学测得的数据计算烧碱样品中氢氧化钠的质量分数(请列出计算过程).
【交流与反思】小强同学认为小婉同学设计的探究方案不够严密,其理由是:
(1)探究方案中没考虑氢氧化钠的吸水性.
(2)探究方案中因缺少
| ||
I.定性探究
【提出问题】烧碱样品中含有哪些杂质?
【猜想】猜想一:可能含有Na2CO3,作出此猜想的依据是
CO2+2NaOH=Na2CO3+H2O
CO2+2NaOH=Na2CO3+H2O
(用化学方程式表示).猜想二:可能含有NaCl,作出此猜想的依据是
可能有少量的氯化钠没有反应
可能有少量的氯化钠没有反应
(用简洁的文字表述).【设计实验】
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁. | 试管外壁发热 | 原因是 氢氧化钠固体溶于水放热 氢氧化钠固体溶于水放热 |
| ②向①所得的溶液中逐渐加入稀硝酸至过量 | 一开始无明显现象,一段时间后产生能使澄清石灰水浑浊的气体 | 样品中含有的杂质是 碳酸钠 碳酸钠 |
| ③向②所得的溶液中滴加几滴硝酸银溶液 | 产生白色沉淀 | 样品中还含有的杂质是 氯化钠 氯化钠 |
不正确
不正确
(填“正确”或“不正确”).II.定量探究
【提出问题】烧碱样品中氢氧化钠的质量分数是多少呢?
【设计实验】小婉同学设计探究方案后进行实验并测得数据如下:

请你利用小婉同学测得的数据计算烧碱样品中氢氧化钠的质量分数(请列出计算过程).
【交流与反思】小强同学认为小婉同学设计的探究方案不够严密,其理由是:
(1)探究方案中没考虑氢氧化钠的吸水性.
(2)探究方案中因缺少
洗涤
洗涤
(填操作名称),导致测得的氢氧化钠的质量分数偏小.分析:二氧化碳与氢氧化钠反应生成碳酸钠和水,因此可能有碳酸钠;氯化钠可能没有全部反应,因此可能有氯化钠.加水溶解,试管外壁发热,原因是氢氧化钠固体溶于水放热;向①所得的溶液中逐渐加入稀硝酸至过量,一开始无明显现象,一段时间后产生能使澄清石灰水浑浊的气体,因此样品中含有的杂质是碳酸钠;向②所得的溶液中滴加几滴硝酸银溶液,产生白色沉淀氯化银,说明样品中还含有的杂质是氯化钠;上述实验中稀硝酸不可以用稀盐酸代替,因为盐酸中有氯离子,影响氯化钠中氯离子的检验.
解答:解:(1)二氧化碳与氢氧化钠反应生成碳酸钠和水,因此可能有碳酸钠;氯化钠可能没有全部反应,因此可能有氯化钠;故答案为:CO2+2NaOH=Na2CO3+H2O;可能有少量的氯化钠没有反应;
(2)加水溶解,试管外壁发热,原因是氢氧化钠固体溶于水放热;向①所得的溶液中逐渐加入稀硝酸至过量,一开始无明显现象,一段时间后产生能使澄清石灰水浑浊的气体,因此样品中含有的杂质是碳酸钠;向②所得的溶液中滴加几滴硝酸银溶液,产生白色沉淀氯化银,说明样品中还含有的杂质是氯化钠;上述实验中稀硝酸不可以用稀盐酸代替,因为盐酸中有氯离子,影响氯化钠中氯离子的检验.故答案为:氢氧化钠固体溶于水放热;碳酸钠;氯化钠;不正确;
(3)设20g样品中含有碳酸钠的质量为x,氯化钠的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 0.22g
=
x=0.53g
NaCl+AgNO3=AgCl↓+NaNO3
58.5 143.5
y 2.87g
=
,y=1.17g
氢氧化钠的质量分数=
×100%=91.5%,
答:氢氧化钠的质量分数是91.5%
故答案为:91.5%;洗涤
(2)加水溶解,试管外壁发热,原因是氢氧化钠固体溶于水放热;向①所得的溶液中逐渐加入稀硝酸至过量,一开始无明显现象,一段时间后产生能使澄清石灰水浑浊的气体,因此样品中含有的杂质是碳酸钠;向②所得的溶液中滴加几滴硝酸银溶液,产生白色沉淀氯化银,说明样品中还含有的杂质是氯化钠;上述实验中稀硝酸不可以用稀盐酸代替,因为盐酸中有氯离子,影响氯化钠中氯离子的检验.故答案为:氢氧化钠固体溶于水放热;碳酸钠;氯化钠;不正确;
(3)设20g样品中含有碳酸钠的质量为x,氯化钠的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 0.22g
| 106 |
| x |
| 44 |
| 0.22g |
NaCl+AgNO3=AgCl↓+NaNO3
58.5 143.5
y 2.87g
| 58.5 |
| y |
| 143.5 |
| 2.87g |
氢氧化钠的质量分数=
| 20g-(0.53g+1.17g) |
| 20g |
答:氢氧化钠的质量分数是91.5%
故答案为:91.5%;洗涤
点评:本考点属于实验探究题,既有物质性质的检验,又有化学方程式的书写和有关的计算,综合性比较强.本题根据题目提供的信息,结合实验探究的一般步骤和碱的性质等知识来解决,还要注意化学方程式的书写和配平,有关的计算要准确.本考点主要出现在实验题中.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
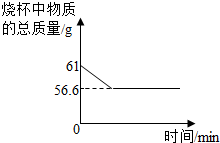 (2012?无锡二模)小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%,具体是什么物质无法辨认.老师告诉他,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种.
(2012?无锡二模)小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%,具体是什么物质无法辨认.老师告诉他,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种.
 ,该粒子一定是氖原子;
,该粒子一定是氖原子;