题目内容
 (2012?无锡二模)小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%,具体是什么物质无法辨认.老师告诉他,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种.
(2012?无锡二模)小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%,具体是什么物质无法辨认.老师告诉他,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种.(1)小亮查阅氢氧化钙常温下的溶解度为0.18g后,认为该溶液不可能是氢氧化钙,理由是
常温下不可能得到质量分数为10%的氢氧化钙溶液
常温下不可能得到质量分数为10%的氢氧化钙溶液
.(2)小亮用洁净干燥的玻璃棒蘸取该溶液滴到湿润的pH试纸上,测得pH=9,他判断该溶液不可能是氯化钠.对他的操作方法、测量结果及结论的评价,正确的是
B
B
;A.方法正确,结果正确,且结论正确 B.方法不正确,结果偏小,但结论正确
C.方法不正确,结果偏大,结论不正确 D.方法正确,结果正确,但结论不正确
(3)为了进一步确定该溶液的成分,小亮继续进行下列实验.
[设计实验方案]方案甲:选择氯化钡溶液来确定该溶液的成份;
方案乙:选择稀硫酸来确定该溶液的成份.
[进行实验]在两个方案中选一个方案,填写步骤、现象、结论.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量溶液于试管,滴加 氯化钡溶液(或稀硫酸) 氯化钡溶液(或稀硫酸) . |
有白色沉淀(或有气泡) 有白色沉淀(或有气泡) |
该溶液是碳酸钠溶液.有关反应的化学方程式为: Na2CO3+BaCl2═BaCO3↓+2NaCl Na2CO3+BaCl2═BaCO3↓+2NaCl . |
①有同学认为还可以用一种常见的碱溶液来确定是碳酸钠,该碱溶液可以是
Ca(OH)2
Ca(OH)2
溶液.有关反应的化学方程式为:
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
.②小亮经过反思,向同学们提出如下建议,你认为不合理的是
C
C
(填字母).A、倾倒液体时应注意保护标签不被腐蚀 B、要有严谨的科学实验的态度
C、无法辨认的药品,直接倒掉,无需保留
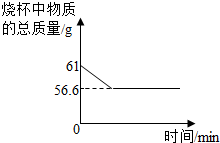
(4)用“侯氏制碱法”制得的纯碱中常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的质量分数,小明称取该样品11 g,加入到盛有一定量稀盐酸的烧杯中,恰好完全反应,测得烧杯中物质总质量的变化如图所示.请计算
①该纯碱样品中碳酸钠的质量分数.(精确到0.1%,下同)
②反应后所得溶液中溶质的质量分数.
分析:(1)根据溶解度与饱和溶液的溶质质量分数的关系,由氢氧化钙常温下的溶解度进行判断;
(2)分析测定溶液酸碱度的操作,指出其中的问题并判断对结果的影响;
(3)[进行实验]根据碳酸钠与稀硫酸或氯化钡溶液反应所出现的现象,完成检验碳酸钠的实验方案的填写;
[实验反思]①根据碳酸钠的性质,判断能与碳酸钠反应且有明显现象出现的碱,写出反应的化学方程式;
②根据节约药品的原则,评价对于无法辨认的药品的处理方法.
(4)根据质量守恒定律可以知道,反应中生成了二氧化碳的质量为61g-56.6g=5g,然后结合反应的化学方程式即可完成解答.
(2)分析测定溶液酸碱度的操作,指出其中的问题并判断对结果的影响;
(3)[进行实验]根据碳酸钠与稀硫酸或氯化钡溶液反应所出现的现象,完成检验碳酸钠的实验方案的填写;
[实验反思]①根据碳酸钠的性质,判断能与碳酸钠反应且有明显现象出现的碱,写出反应的化学方程式;
②根据节约药品的原则,评价对于无法辨认的药品的处理方法.
(4)根据质量守恒定律可以知道,反应中生成了二氧化碳的质量为61g-56.6g=5g,然后结合反应的化学方程式即可完成解答.
解答:解:(1)常温下氢氧化钙的溶解度为0.18g,所以其饱和溶液的溶质的质量分数为:
×100%=0.18%<10%,所以该溶液不可能为氢氧化钙溶液;
(2)测定溶液的酸碱度时,不可把pH试纸用水湿润,这样测定的碱溶液的酸碱度会因加水稀释而偏小,但根据测得的酸碱度为10判断溶液呈碱性还是正确的;故选B;
(3)[进行实验]可利用碳酸钠与氯化钡溶液混合能形成白色沉淀,检验溶液为碳酸钠;
[实验反思]①根据碳酸钠溶液与澄清石灰水混合可使溶液因生成碳酸钙沉淀而变浑浊的现象,利用氢氧化钙溶液检验碳酸钠,该反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
②对于标签被腐蚀的试剂,本着节约原则,应尽可能确定药品的组成,不可随意扔弃,既不安全又造成浪费;故C不可取;
(4)根据质量守恒定律结合图中的信息可以知道,烧杯中减少的质量为反应生成的二氧化碳的质量,所以反应中生成了二氧化碳的质量为61g-56.6g=4.4g,
设样品中碳酸钠的质量为x,生成的氯化钠是y.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
=
=
解得:x=10.6g
y=11.7g
①该纯碱样品中碳酸钠的质量分数为:
×100%=96.4%.
②反应后所得溶液中溶质的质量分数为:
×100%=21.4%.
答:①该纯碱样品中碳酸钠的质量分数为96.4%;
②反应后所得溶液中溶质的质量分数21.4%.
(1)常温下不可能得到质量分数为10%的氢氧化钙溶液;
(2)B
(3)
①Ca(OH)2;Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
②C;
(4)①96.4%;
②21.4%.
| 0.18g |
| 0.18g+100g |
(2)测定溶液的酸碱度时,不可把pH试纸用水湿润,这样测定的碱溶液的酸碱度会因加水稀释而偏小,但根据测得的酸碱度为10判断溶液呈碱性还是正确的;故选B;
(3)[进行实验]可利用碳酸钠与氯化钡溶液混合能形成白色沉淀,检验溶液为碳酸钠;
[实验反思]①根据碳酸钠溶液与澄清石灰水混合可使溶液因生成碳酸钙沉淀而变浑浊的现象,利用氢氧化钙溶液检验碳酸钠,该反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
②对于标签被腐蚀的试剂,本着节约原则,应尽可能确定药品的组成,不可随意扔弃,既不安全又造成浪费;故C不可取;
(4)根据质量守恒定律结合图中的信息可以知道,烧杯中减少的质量为反应生成的二氧化碳的质量,所以反应中生成了二氧化碳的质量为61g-56.6g=4.4g,
设样品中碳酸钠的质量为x,生成的氯化钠是y.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
| 106 |
| x |
| 117 |
| y |
| 44 |
| 4.4g |
解得:x=10.6g
y=11.7g
①该纯碱样品中碳酸钠的质量分数为:
| 10.6g |
| 11g |
②反应后所得溶液中溶质的质量分数为:
| 11g-10.6g+11.7g |
| 56.6g |
答:①该纯碱样品中碳酸钠的质量分数为96.4%;
②反应后所得溶液中溶质的质量分数21.4%.
(1)常温下不可能得到质量分数为10%的氢氧化钙溶液;
(2)B
(3)
| 取少量溶液于试管,滴加氯化钡溶液 | 有白色沉淀 | 该溶液是碳酸钠溶液.有关反应的化学方程式为:Na2CO3+BaCl2═BaCO3↓+2NaCl. |
②C;
(4)①96.4%;
②21.4%.
点评:本题根据氢氧化钠、氯化钠、氢氧化钙、碳酸钠几种物质的性质特点,采取“利用测定结果进行先排除,最后进行实验检验的”方法确定未知溶液,涉及对四种物质相关性质及变化规律的考查.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目