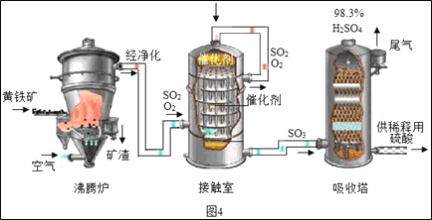
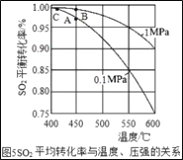
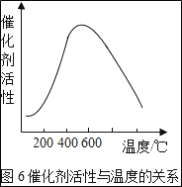
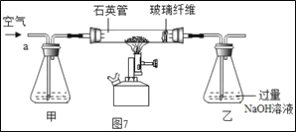
��Ŀ����
����Ŀ���Ķ����ڡ�21���͵���Դ��������ﮣ�Li�����Ŀ��ն��ģ��ش����⡣
���һ������ɫ�������ʽ������ܶȱ����е��Ͷ�С����Ӧ�����Һ̬ʯ���С������ϡ����Ѹ�ٷ�Ӧ��������ﮣ�Li2SO4������������ˮ��Ӧ����������﮺����������ҷų�������1800�귢�������ϵ�һ����أ�����½�������˸ɵ�ء�Ǧ���ء�﮵����21���Ͳ����ƿ�����������Դ���Ǻ���ǰ;�Ķ�����ء���ǰ�ֻ��й㷺ʹ�õĵ�ء���Ҫ�Ǹ���﮵�ء���﮵�ط����������������г���ֻ����ͨ���ͷ���������1/3��﮵�ضԻ�����Ӱ�첻����������ʹ�úͱ��϶��������κ�Ǧ�������ӵ��ж��к��ؽ���Ԫ�غ����ʡ�
��1�����ݶ������ݹ��ɳ�﮵���������_____��дһ�㣩��
��2���û�ѧ����ʽ��ʾ﮵�һ����ѧ����_____��
��3�����ݶ��������жϣ���Ż���_____����ܡ����ܡ�����ˮ���������������Li��Hg�Ľ��������ǿ������˳����_____��
��4���ֻ����綯���г����綯�����㷺ʹ��﮵�ص��ŵ���_____��
���𰸡������壨���ܶȱ���С�� ![]() ��
�� ![]() ���� Li��Hg �Ի�������Ⱦ
���� Li��Hg �Ի�������Ⱦ
��������
��1�����������Dz���Ҫ������ѧ�仯�ͱ��ֳ��������ʣ�����﮵����������ǣ�����ɫ�������ܶȱ���С��
��2��﮺�ˮ��Ӧ����������﮺������������ϡ����Ѹ�ٷ�Ӧ��������﮺���������ѧ����ʽΪ��![]() ��
��![]() ��
��
��3����Ż��˲�����ˮ���ԭ���������ˮ��Ӧ�������������������ϡ����Ѹ�ٷ��������������ᷴӦ�����ʣ���֪﮵Ľ�����Աȹ�ǿ��
��4��﮵�ع㷺�����ֻ����綯���г����綯�����ĺô��ǶԻ�������Ⱦ��

 �ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
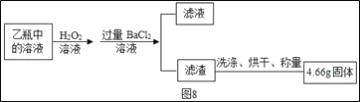
�ƸԺ���ȫ�����Ų��Ծ�ϵ�д�����Ŀ��ʵ������һ������ҩƷ�����ܺ���BaSO4��Na2CO3��CuSO4��NaCl��CaCl2��NaOH�е�һ�ֻ��֣�Ϊȷ����ɷ֣�ij��ͬѧ����ʦ��ָ���½���̽����
��һ������̽����
��.��ȡ������Ʒ����������ˮ�г���ܽ⣬���˺�õ���ɫ��������ɫ��Һ����ʵ�������֪��ԭ������һ������____��
��.ȡ���еõ�����Һ���������ʵ�����̽��ԭ����ijɷ֣�����������ʵ�鱨�沢�ش����⡣
���� | ���� | ���� |
����Һ�м��������Ȼ�����Һ | ������ɫ���� | ԭ������һ������____ |
ȡ�ϲ���Һ���μ�____ | ____ | ԭ�����в���NaOH |
���У��������������Ȼ�����Һ��Ŀ�ij��˼���һ�����е������⣬������������____��
��.��ȡ���еõ�����Һ�������������²�����
![]()
ͬѧ����Ϊ��ԭ������һ������NaCl��������ʦָ��������۲���ȷ����������___������ţ�
A.��Һ�к���Na2CO3��Ҳ�ܺ�AgNO3��Ӧ���ɳ���
B.��Һ�е�NaCl��������ԭ�����е�Na2CO3��CaCl2��Ӧ����
����������̽����
����ʦ��ָ����ͬѧ���־�ȷ������10gԭ���壬��������ʵ�飺
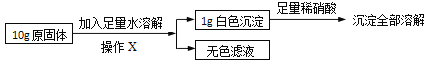
ͬѧ����Ϊ�����ݡ�����ȫ���ܽ⡱�������ȷ����ɫ�����ijɷ���____����ԭ������һ������____�����У�����X��������____����ɫ��Һ��һ�����е���������____��
�Ը������ɳ�������������ԭ�������Ȼ��Ƶ�����������д���������_____��