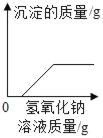
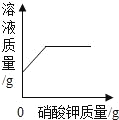
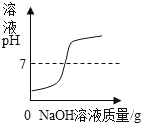
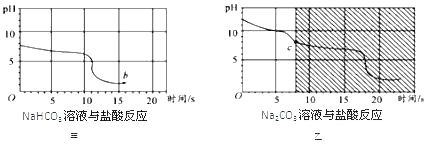
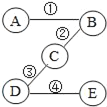
��Ŀ����
����Ŀ��ij�����ķ�ˮ�к���MgSO4��FeCl3��������Ա����NaOH��Һ���ڷ�ˮ��pH���Ⱥ��������ֳ�������ͨ��ϵ�д����õ��м�ֵ�IJ�Ʒ��

��֪��Mg��OH��2��Fe��OH��3��������ˮ�����Ȼᷢ���ֽ⡣���������̣��ش��������⣺
��1����������������_____��������ʱ��������_____����ֹͣ���ȡ�
��2������A��ij�ᷴӦ�Ļ�ѧ����ʽΪ_____��
��3������B���ȵõ�Fe2O3��Ӧǰ����Ԫ�ػ��ϼ۵ı仯�����_____������ߡ��������͡����䡱����
��4����Һa���˿��ܺ���NaOH�⣬��һ�����е�������_____���ѧʽ����
���𰸡����� �϶������� H2SO4+Mg��OH��2��MgSO4+2H2O ���� NaCl��Na2SO4
��������
��1�������� ʵ���˹�Һ���룬�ò���Ϊ���ˣ�������ˣ�
������ �������������������϶�������ʱֹͣ���ȣ�����϶������塣
��2����ͼ��֪������A���Ȼ�þ���������Ʒ�Ӧ���ɵ�������þ������������þ�����ᷴӦ��������þ��ˮ���ʷ�Ӧ�Ļ�ѧ����ʽдΪ��Mg��OH��2+H2SO4��MgSO4+2H2O��
��3����ͼ��֪������B���Ȼ������������Ʒ�Ӧ���ɵ��������������������������ȷֽ�Ϊ��������ˮ����������������������Ԫ�ؾ���+3�ۣ�����䡣
��4������þ���������Ʒ�Ӧ���������ƺ�������þ�������Ȼ������������Ʒ�Ӧ�������������������Ȼ��ƣ�������Һa���˿��ܺ���ʣ���NaOH�⣬��һ�����е����������ɵ�NaCl��Na2SO4������NaCl��Na2SO4��

 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�