题目内容
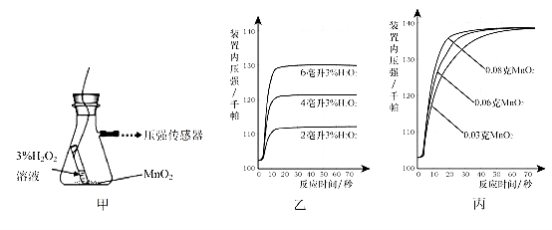
【题目】(6分)利用图甲装置探究“二氧化锰(MnO2)的用量对过氧化氢(H2O2)分解反应的影响”,实验中过氧化氢溶液的浓度为3%,装置中产生氧气的量可以用压强传感器测出(在等温条件下,产生氧气体积与装置内压强成正比.反应放热等其它因素均忽略不计.)
(1)写出甲装置中发生反应的文字表达式: ,
(2)图乙是“0.1克二氧化锰与不同体积的浓度为3%的过氧化氢溶液混合”的实验结果,从图中可以看出: .
(3)当用“浓度为3%H2O2溶液8毫升与不同质量的MnO2混合”时,得到如图丙所示的曲线.曲线的斜率显示,当MnO2的用量增加到0.08克时,分解速度达到实验要求.在此实验条件下,若MnO2的质量有4克(一药匙),就能使如图 (选填字母)烧杯中所装的浓度为3%H2O2溶液,其分解速度最接近实验要求.

【答案】(1)过氧化氢![]() -水+氧气
-水+氧气
(2)过氧化氢的用量越多,产生的氧气越多(3)C
【解析】
试题分析:(1)甲装置中发生反应的文字表达式:过氧化氢![]() -水+氧气,(2)有图中提供的信息可知过氧化氢的用量越多,产生的氧气越多.(3)有题中催化剂与过氧化氢的体积比可求出,4克,二氧化锰需要的过氧化氢的体积为8/0.08×4=400ml,故选择C
-水+氧气,(2)有图中提供的信息可知过氧化氢的用量越多,产生的氧气越多.(3)有题中催化剂与过氧化氢的体积比可求出,4克,二氧化锰需要的过氧化氢的体积为8/0.08×4=400ml,故选择C

【题目】某校化学兴趣小组就空气中氧气的含量进行实验探究:(9分)
[集体讨论]:
(1)讨论后同学们认为,选择的药品既要能消耗氧气,又不会跟空气中的其它成分反应,而且生成物为固体。他们应该选择(填编号) 。
A.蜡烛 B.红磷 C.硫粉
为了充分消耗容器中的氧气,药品的用量应保证 。

(2)小组同学共同设计了如下图的两套装置, 你认为合理的是(填编号) 。
为了确保实验的成功,在装药品之前应该 。
[分组实验] 在讨论的基础上,他们分组进行了实验。
[数据分析] 实验结束后,整理数据如下:(注:集气瓶容积为100mL)
组 别 | 1 | 2 | 3 | 4 | 5 | 6 |
进入集气瓶中水的体积(mL) | 20 | 21 | 14 | 20 | 28 | 19 |
(3)根据燃烧红磷测定空气中氧气含量的实验原理是 。
[分组讨论]
(4)第三组同学进入集气瓶中水的体积明显比其他组同学少,原因是 (答一条)
第五组同学进入集气瓶中水的体积明显比其他组同学多,原因是 (答一条)
(5)通过对实验结果的交流,大多数同学都验证出氧气约占空气体积的 。
[实验总结]
(6)小组的同学反思上述实验的探究过程后认为:用燃烧法测定空气中氧气含量的实验时,在药品的选择或生成物的要求上应考虑的是 。