题目内容
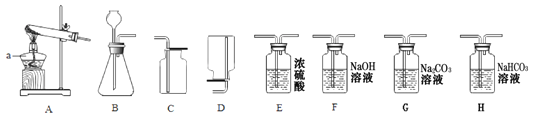
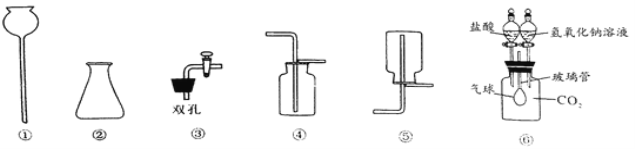
【题目】实验室常用的制取气体的发生装置如下:

①仪器a的名称是 ;搭建B装置时,酒精灯应在固定仪器a之 (选填“前”或“后”)放置。
②实验室用过氧化氢溶液和二氧化锰混合制取氧气,反应的化学方程式是 。
③在实验室制取二氧化碳的研究中,进行了如下实验:
药品 实验编号 | 甲 | 乙 | 丙 | 丁 |
大理石 | m g,块状 | m g,块状 | m g,粉末状 | m g,粉末状 |
盐酸(过量) | w g,稀盐酸 | w g,浓盐酸 | w g,稀盐酸 | w g,浓盐酸 |
I.上述实验中反应的化学方程式是 。
II.若要研究盐酸浓度大小对反应的影响,可选择实验甲与 对照(选填实验编号)。
III.除盐酸的浓度外,上述实验研究的另一个影响反应的因素是 。
IV.研究发现酸的浓度越大,产生气体的速度越快,与甲比较,对丁分析正确的是 (选填编号)
A、反应更为剧烈
B、最终剩余溶液的质量更小
C、产生的二氧化碳的质量更大
D、粉末状大理石利用率更高
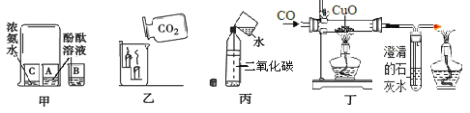
④下表中的两个实验,尽管在原料状态、发生装置等方面存在差异,却都能控制气体较平稳地产生。请从实验目的、原理、原料、装置、操作等方面思考后,具体阐述每个实验中气体较平稳产生的最主要的一个原因。
目的 | 原料 | 发生装置 | 气体较平稳产生的最主要的一个原因 |
制取二氧化碳 | 块状大理石 稀盐酸 | A | |
制取氧气 | 粉末状二氧化碳 3%的过氧化氢溶液 | B |
【答案】①试管 前 ②2H2O2 ![]() 2H2O +O2↑③CaCO3 + 2HCl==CaCl2 + CO2↑ + H2O;乙;固体反应物的颗粒大小;ab ④反应物的接触面积较小;通过分液漏斗控制液体的滴加速度
2H2O +O2↑③CaCO3 + 2HCl==CaCl2 + CO2↑ + H2O;乙;固体反应物的颗粒大小;ab ④反应物的接触面积较小;通过分液漏斗控制液体的滴加速度
【解析】
试题分析:酒精灯应该在试管固体之前放置,可以更好的调节试管的高低,保证能够用酒精灯的外焰加热;过氧化氢分解制取氧气的方程式为2H2O2 ![]() 2H2O +O2↑;制取二氧化碳的化学方程式为:CaCO3 + 2HCl==CaCl2 + CO2↑ + H2O;为了研究盐酸浓度对反应的影响可以选择甲与乙来对照,该实验还能验证出反应还与固体反应物的颗粒大小有关;对于丁来说,反应会更为剧烈,因为固体变为粉末状,增大了接触面积,同时酸的浓度更大,使得反应的速度加快;制取二氧化碳时获得平稳的气体的原因是块状固体比粉末状固体的接触面积变小,从而反应的速度减慢;制取氧气中用了C装置,可以通过分液漏斗控制液体的滴加速度,从而控制反应的速度。
2H2O +O2↑;制取二氧化碳的化学方程式为:CaCO3 + 2HCl==CaCl2 + CO2↑ + H2O;为了研究盐酸浓度对反应的影响可以选择甲与乙来对照,该实验还能验证出反应还与固体反应物的颗粒大小有关;对于丁来说,反应会更为剧烈,因为固体变为粉末状,增大了接触面积,同时酸的浓度更大,使得反应的速度加快;制取二氧化碳时获得平稳的气体的原因是块状固体比粉末状固体的接触面积变小,从而反应的速度减慢;制取氧气中用了C装置,可以通过分液漏斗控制液体的滴加速度,从而控制反应的速度。

 阅读快车系列答案
阅读快车系列答案