题目内容
【题目】实验室有一瓶长期存放的固体氢氧化钠,由于保管不当已经变质。某兴趣小组的同学欲通过实验测定其变质的情况。实验过程如下:取样品25g放入烧杯中,向其中加入280g过量的稀盐酸,得到296.2g溶液。试计算25g样品中碳酸钠的质量。
【答案】44.8%
【解析】
试题分析:氢氧化钠能和空气中的二氧化碳气体反应生成碳酸钠而变质。碳酸钠和稀盐酸反应可生成二氧化碳气体。所以反应中物质质量的减少值即为生成二氧化碳的质量。再结合化学方程式中生成二氧化碳与反应的碳酸钠的质量关系即可求解。具体过程如下:
解:生成二氧化碳的质量为:25g+280g—296.2g=8.8g
设样品中含有碳酸钠的质量为x,
2HCl+Na2CO3═2NaCl+H2O+CO2↑
106 44
x 8.8g
![]()
x=21.2g
答:样品中碳酸钠的质量为21.2g

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】(8分)在浓硫酸的催化作用下,固体草酸(H2C2O4)受热分解生成碳的氧化物和水。某化学课外兴趣小组对生成物中碳的氧化物种类进行了如下实验探究:
【提出问题】生成物中有哪几种碳的氧化物?
【猜测】
猜想1 | 猜想2 | 猜想3 |
只有CO | 只有 | 含有CO和CO2 |
【设计实验】基于猜想3,依据CO和CO2的性质,兴趣小组同学设计了如下实验:
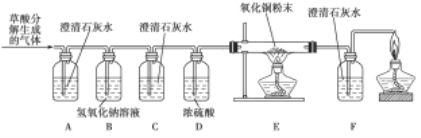
【实验探究】
(1)观察到 装置(填序号)中的澄清石灰水变浑浊,证明草酸分解有CO2气体生成。
(2)有两种实验现象都能分别证明草酸分解的气体中含有CO:
①C装置中澄清石灰水不变浑浊,F装置中 ;
②E装置中出现 的现象。
【实验结论】通过实验探究证明:猜测3成立。
草酸分解的化学方程式是 。
【问题讨论】
(1)B装置的作用是 ;D装置的作用是 。
(2)装置末端酒精灯的作用是 。