题目内容
【题目】实验室常用下列装置制取气体,请你根据所学知识回答下列问题。
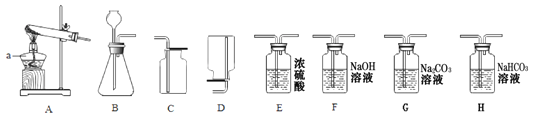
(1)仪器a的名称是 。
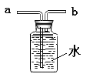
(2)实验室制取氧气时,选用的收集装置是 (填字母序号)。若改用下图装置收集氧气,则气体应从 进(填“a”或“b”)。
(3)小明取一定浓度的盐酸与石灰石反应制取气体,反应的化学方程式为__________;将生成的气体通入澄清石灰水中,未见变浑浊。为探究其原因,进行了如下过程:
【作出猜想】A.石灰水已经完全变质;
B.气体中有挥发出来的HCl气体。
【实验探究】
①取少量石灰水于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到溶液变红色。于是排除了猜想A,你认为排除猜想A的理由是_____________。
②小明想探究所得气体中是否有挥发出来的HCl气体,设计如下实验。请你帮他完成实验,填写以下表格:
实验步骤 | 实验现象 | 实验结论 |
气体中有HCl |
【查阅资料】
碳酸钠溶液中通入二氧化碳发生反应:Na2CO3 + CO2 + H2O = 2NaHCO3
【拓展延伸】
如果用上述原料制得纯净的二氧化碳气体,所选仪器的连接顺序为 (填字母)。
【答案】(1)酒精灯 (2)C b
(3)CaCO3+2HCl=CaCl2+CO2↑+H2O
①酚酞试液变红,说明溶液中存在碱性物质Ca(OH)2
②
实验步骤 | 实验现象 | 实验结论 |
将生成的气体通入AgNO3 溶液中 | 产生白色沉淀 | 气体中有HCl |
B H E C
【解析】
试题分析:(2)氧气的密度比空气大,难溶于水,可用向上排空气法或排水法收集,故选C装置;右图装置是用排水法收集氧气,由于水只能从a端排水,故氧气从b端通入;
(3)碳酸钙与稀盐酸反应生成的是氯化钙、水和二氧化碳:CaCO3+2HCl=CaCl2+CO2↑+H2O;
【实验探究】①酚酞试液变红,说明溶液呈碱性,即含有氢氧化钙,若氢氧化钙完全变质了,那么氢氧化钙与二氧化碳反应生成的是碳酸钙沉淀和水,不能使酚酞试液变成红色;
②氯化氢气体溶于水形成的盐酸,要证明含有盐酸,即证明含有氯离子,那么可将气体通入硝酸银溶液中,若产生了白色沉淀,则证明含有氯化氢气体;
【拓展延伸】要得到纯净的二氧化碳气体,那么要先把氯化氢气体和水蒸汽除去,其中氯化氢气体可用饱和的碳酸氢钠溶液除去,水蒸汽可用浓硫酸除去,故顺序是B H E C。

【题目】把一定质量的a,b,c,d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如表,下列说法中正确的是
物质 | a | b | c | d |
反应前的质量(g) | 7.8 | 3.2 | 4.0 | 2.8 |
反应后的质量(g) | 6.6 | X | 4.0 | 6.0 |
A.该反应是化合反应
B.C一定是催化剂
C.X=2.0
D.b和d是生成物