题目内容
【题目】下图是实验室用石灰石与稀盐酸反应制取二氧化碳并验证其性质的的实验装置图,试根据题目要求回答下列问题:
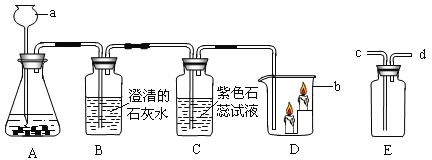
(1)仪器a的名称是________ ;装置A中发生反应的化学方程式________ ;装置C中观察到的现象是________ 。
(2)装置D中观察到的现象是________ ,说明二氧化碳的密度比空气大,它不能燃烧,也不能支持燃烧。由此可知,二氧化碳在生活中可用于________。
(3)实验室用装置E来收集二氧化碳时,二氧化碳应从________ (填“c端”或“d端”)通入。
【答案】长颈漏斗 CaCO3+2HCl=CaCl2+H2O+CO2↑ 紫色石蕊试液变红 下层蜡烛先熄灭 灭火 c端
【解析】
(1)仪器a是长颈漏斗;装置A中是石灰石与稀盐酸的反应,石灰石与稀盐酸反应生成氯化钙、水、二氧化碳;装置A中产生的二氧化碳经B进入C中,二氧化碳能使紫色石蕊试液变红。
(2)由于二氧化碳的密度比空气的密度大,故D中的下层蜡烛先熄灭。该实验说明二氧化碳的密度比空气大,二氧化碳不能燃烧,也不能支持燃烧。由此可知,二氧化碳在生活中可用于灭火。
(3)实验室用装置E来收集二氧化碳时,由于二氧化碳的密度比空气的密度大,进入以后占据下方空间,空气被赶到上方空间而易从d端排出,故二氧化碳从c端通入。

【题目】一定 条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如下表:
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量(g) | 20 | m | 8 | 6 |
反应后质量(g) | 4 | 待测 | 28 | 2 |
关于此反应,下列描述正确的是( )
A. 乙是该反应的催化剂
B. “待测”数值一定为2
C. 反应中甲与丙的质量比为1:7
D. 该反应可能是铜和氧气反应
【题目】某同学从定量角度研究双氧水制取氧气的过程,对原实验进行部分改进,增加了称量操作.具体做法是:取10%的双氧水和少量的二氧化锰放入气体发生装置,并对反应前后混合物的质量进行称量,记录如下: 若反应后,双氧水分解完全且氧气全部逸出,该同学得出的结论中,不合理的是()
反应过程 | 反应前 | 反应后 |
质量变化(不含容器质量) | 34.3g | 32.7g |
A. 反应速率逐渐加快 B. 最多得到氧气的质量为1.6g
C. 催化剂二氧化锰的质量为0.3gD. 反应得到水和氧气的质量比为9:8