题目内容
铝元素的氧化物化学式为Al2O3,若Al的化合价不变,则铝元素的氯化物的化学式为
- A.AlCl
- B.Al3Cl
- C.AlCl2
- D.AlCl3
D
分析:首先要熟记常见元素与常见原子团的化合价:铝元素的化合价为+3价,氧元素的化合价为-2价;掌握化合价的规律和原则:(在化合物中正、负化合价的代数和为零).
解答:由题意可知:铝元素的氧化物化学式为Al2O3,,又因为氧元素的化合价为-2价,故可知铝元素的化合价为+3价;因为Al的化合价不变,因为氯元素与金属元素形成化合物时,常显-1价;利用化合价数值交叉法书写化学式(即将正、负化合价的数值交叉到相应符号的右下角,但注意原子团看作一体,含约数的一般要约分).先标注化合价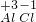 ,再利用化合价数值交叉法书写化学AlCl3.
,再利用化合价数值交叉法书写化学AlCl3.
故选D.
点评:本题既考查了化合价与离子表示方法上的异同点,又考查了常见元素与常见原子团的化合价以及化合价的规律和原则,还考查了化学式的书写方法和技巧.
分析:首先要熟记常见元素与常见原子团的化合价:铝元素的化合价为+3价,氧元素的化合价为-2价;掌握化合价的规律和原则:(在化合物中正、负化合价的代数和为零).
解答:由题意可知:铝元素的氧化物化学式为Al2O3,,又因为氧元素的化合价为-2价,故可知铝元素的化合价为+3价;因为Al的化合价不变,因为氯元素与金属元素形成化合物时,常显-1价;利用化合价数值交叉法书写化学式(即将正、负化合价的数值交叉到相应符号的右下角,但注意原子团看作一体,含约数的一般要约分).先标注化合价
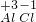 ,再利用化合价数值交叉法书写化学AlCl3.
,再利用化合价数值交叉法书写化学AlCl3.故选D.
点评:本题既考查了化合价与离子表示方法上的异同点,又考查了常见元素与常见原子团的化合价以及化合价的规律和原则,还考查了化学式的书写方法和技巧.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
铝元素的氧化物化学式为Al2O3,若Al的化合价不变,则铝元素的氯化物的化学式为( )
| A、AlCl | B、Al3Cl | C、AlCl2 | D、AlCl3 |
元素周期律是学习和研究化学的重要工具.下表是元素周期表的部分信:
认真分析信息,回答:
(1)分析上表规律,可推知,表中X=______;
(2)地壳中含量最多的金属元素的原子核内质子数是______,该元素的氧化物化学式为______.
(3)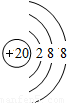 表示的是(写粒子符号)______.
表示的是(写粒子符号)______.
(4)实验证明:在上表同一横行中,从左到右,原子失去电子的能力逐渐减弱,得电子能力逐渐增强;同一纵行中,从上到下,原子失去电子的能力逐渐增强,得电子能力逐渐减弱.则上图元素中失去电子能力最强的元素原子是______(填原子符号,下同),得电子能力最强的元素原子是______.
| 1 H 氢 |  | 2 He 氦 | ||||||
| 3 Li 锂 | 4 Be 铍 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | |
| 11 Na 钠 | 12 Mg 镁 | 13 Al 铝 | 14 Si 硅 | 15 P 磷 | 16 S 硫 | X Cl 氯 | 18 Ar 氩 | |
| 19 K 钾 | 20 Ca 钙 | … | ||||||
(1)分析上表规律,可推知,表中X=______;
(2)地壳中含量最多的金属元素的原子核内质子数是______,该元素的氧化物化学式为______.
(3)
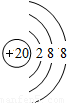 表示的是(写粒子符号)______.
表示的是(写粒子符号)______.(4)实验证明:在上表同一横行中,从左到右,原子失去电子的能力逐渐减弱,得电子能力逐渐增强;同一纵行中,从上到下,原子失去电子的能力逐渐增强,得电子能力逐渐减弱.则上图元素中失去电子能力最强的元素原子是______(填原子符号,下同),得电子能力最强的元素原子是______.