题目内容
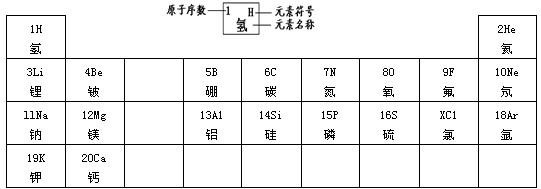
元素周期律是学习和研究化学的重要工具.下表是元素周期表的部分信:| 1 H 氢 |  | 2 He 氦 | ||||||
| 3 Li 锂 | 4 Be 铍 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | |
| 11 Na 钠 | 12 Mg 镁 | 13 Al 铝 | 14 Si 硅 | 15 P 磷 | 16 S 硫 | X Cl 氯 | 18 Ar 氩 | |
| 19 K 钾 | 20 Ca 钙 | … | ||||||
(1)分析上表规律,可推知,表中X=______;
(2)地壳中含量最多的金属元素的原子核内质子数是______,该元素的氧化物化学式为______.
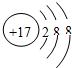
(3)
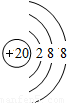 表示的是(写粒子符号)______.
表示的是(写粒子符号)______.(4)实验证明:在上表同一横行中,从左到右,原子失去电子的能力逐渐减弱,得电子能力逐渐增强;同一纵行中,从上到下,原子失去电子的能力逐渐增强,得电子能力逐渐减弱.则上图元素中失去电子能力最强的元素原子是______(填原子符号,下同),得电子能力最强的元素原子是______.
【答案】分析:根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,同一周期元素从左到右原子序数逐渐递增,在表同一横行中,从左到右,原子失去电子的能力逐渐减弱,得电子能力逐渐增强;同一纵行中,从上到下,原子失去电子的能力逐渐增强,得电子能力逐渐减弱,进行分析解答本题.
解答:解:(1)分析表中规律同一周期元素从左到右原子序数逐渐递增,X介于16和18之间,可推知,表中X=17;故答案为:17;
(2)地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,由此可知含量最多的金属元素是铝,它的原子核内质子数从元素周期表中可查得是13,氧化物化学式为 Al2O3,故答案为:13;Al2O3;
(3)根据粒子的结构示意图可知质子数=20>核外电子数=18,由此可知该原子失去2个电子,粒子符号为Ca2+,故选Ca2+;
(4)根据在表同一横行中,从左到右,原子失去电子的能力逐渐减弱,得电子能力逐渐增强;同一纵行中,从上到下,原子失去电子的能力逐渐增强,得电子能力逐渐减弱.则元素中失去电子能力最强的元素原子是 K,得电子能力最强的元素原子是 F,故答案为:K;F.
点评:本题可查学生根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,同一周期元素从左到右原子序数逐渐递增,在表同一横行中,从左到右,原子失去电子的能力逐渐减弱,得电子能力逐渐增强;同一纵行中,从上到下,原子失去电子的能力逐渐增强,得电子能力逐渐减弱,进行分析解题的能力.
解答:解:(1)分析表中规律同一周期元素从左到右原子序数逐渐递增,X介于16和18之间,可推知,表中X=17;故答案为:17;
(2)地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,由此可知含量最多的金属元素是铝,它的原子核内质子数从元素周期表中可查得是13,氧化物化学式为 Al2O3,故答案为:13;Al2O3;
(3)根据粒子的结构示意图可知质子数=20>核外电子数=18,由此可知该原子失去2个电子,粒子符号为Ca2+,故选Ca2+;
(4)根据在表同一横行中,从左到右,原子失去电子的能力逐渐减弱,得电子能力逐渐增强;同一纵行中,从上到下,原子失去电子的能力逐渐增强,得电子能力逐渐减弱.则元素中失去电子能力最强的元素原子是 K,得电子能力最强的元素原子是 F,故答案为:K;F.
点评:本题可查学生根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,同一周期元素从左到右原子序数逐渐递增,在表同一横行中,从左到右,原子失去电子的能力逐渐减弱,得电子能力逐渐增强;同一纵行中,从上到下,原子失去电子的能力逐渐增强,得电子能力逐渐减弱,进行分析解题的能力.

练习册系列答案
相关题目

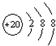 表示的是(写粒子符号)
表示的是(写粒子符号)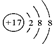 表示的是(填名称)
表示的是(填名称)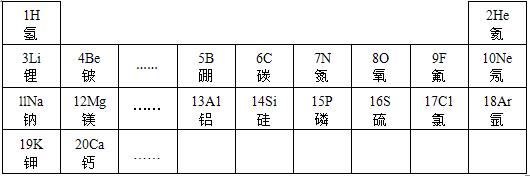
 表示的是
表示的是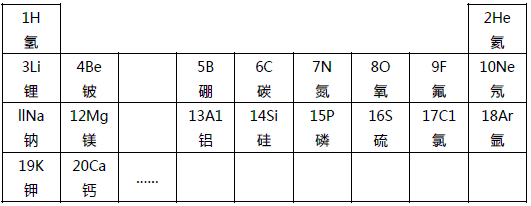
 (1)地壳中含量最多的金属元素的符号是 ;
(1)地壳中含量最多的金属元素的符号是 ;