题目内容
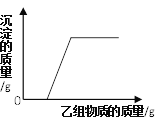
【题目】取氯化钙和盐酸的混合溶液51.88g,逐滴滴加10.6%的碳酸钠溶液。所加入碳酸钠溶液的质量和混合溶液pH变化关系如图所示,回答下列问题:
(可能用到的相对分子质量:CaCl2﹣111 HCl﹣36.5 Na2CO3﹣106 NaCl﹣58.5 CaCO3﹣100 CO2﹣44 H2O﹣18)
(1)BC段反应的化学方程式为_____。
(2)CD段溶液pH>7的原因是_____。
(3)计算充分反应至C点时所得溶液中溶质的质量分数(写出计算过程,计算结果精确至0.1%)_____。
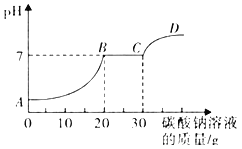
【答案】 Na2CO3+CaCl2═CaCO3↓+2NaCl 碳酸钠溶液本身显碱性,pH>7 4.4%
【解析】
AB段发生的反应是盐酸和碳酸钠的反应,BC段发生的反应是氯化钙和碳酸钠的反应,CD段加入碳酸钠,但是没有发生化学反应。
(1)BC段反应的化学方程式为Na2CO3+CaCl2═CaCO3↓+2NaCl;
(2)CD段加入碳酸钠,碳酸钠没有发生化学反应,碳酸钠溶于水显碱性,溶液pH大于7;
(3)设AB段反应生成的氯化钠的质量为x,生成的二氧化碳的质量为y,BC段反应生成的氯化钠的质量为z,生成的碳酸钙的质量为a
则Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
20g×10.6% x y
![]()
x=2.34g,y=0.88g
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100 117
10×10.6% a z
![]()
a=1g,z=1.17g
![]()
充分反应至C点时所得溶液中溶质的质量分数![]() 。
。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目