题目内容
【题目】工业上常利用石灰浆(主要成分为Ca(OH)2)制备化工原料KClO3,流程如下:

(资料)有关物质在20摄氏度时的溶解度如下:
物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
(1)操作a的名称是_____,在实验室中完成此操作需要的玻璃仪器有烧杯、玻璃棒、_____,玻璃棒是作用是_____。
(2)反应1向石灰浆中通入Cl2,得到Ca(ClO3)2、CaCl2的混合溶液。化学方程式中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此化学方程式_____。
(3)提高Cl2转化为Ca(ClO3)2的转化率的可行措施有_____(填序号)。
A 适当加大通入Cl2的速率
B 充分搅拌浆料
C 加水使Ca(OH)2完全溶解
D 加热
(4)反应2为复分解反应,则溶液A中含有的溶质为CaCl2和_____(填化学式),你认为该反应能得到KClO3晶体的原因是_____。
(5)洗涤KClO3晶体时,可选用_____(填序号)。
A 饱和KCl溶液
B 饱和CaCl2溶液
C 饱和KClO3溶液
【答案】过滤 漏斗 引流 6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O B KClO3 氯酸钾在20摄氏度时,溶解度仅为7.3g,比较小 C
【解析】
(1)操作a将固体与液体分离的名称是过滤,在实验室中完成此操作需要的玻璃仪器有烧杯、玻璃棒、漏斗,玻璃棒是作用是:引流,防止液体飞溅。
(2)反应1向石灰浆中通入Cl2,得到Ca(ClO3)2、CaCl2和水的混合溶液的化学方程式:6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O;
(3)提高Cl2转化为Ca(ClO3)2的转化率的可行措施有
A、适当加大通入Cl2的速率,不能提高氯气的转化率;
B、充分搅拌浆料,使氯气更多的接触氢氧化钙溶液,可以提高氯气的转化率;
C、加水使Ca(OH)2完全溶解,氢氧化钙溶解度很小,加水后浓度过低,对后续试验不利,不能提高氯气的转化率;
D、加热,氢氧化钙的溶解度降低,不能提高氯气的转化率;
故选:B。
(4)反应2为复分解反应,氯化钾与氯酸钙反应产生氯酸钾和氯化钙的反应化学方程式:KCl+Ca(ClO3)2=CaCl2+2KClO3,过滤氯酸钾晶体是,剩余溶液A为氯酸钾的饱和溶液,则溶液中含有的溶质为CaCl2和KClO3,该反应能得到KClO3晶体的原因是:氯酸钾在20摄氏度时,溶解度仅为7.3g,比较小;
(5)洗涤KClO3晶体时,可选用用饱和KClO3溶液洗涤,该溶液不能溶解氯酸钾,但可以溶解其他物质;
故选:C。

 名校课堂系列答案
名校课堂系列答案【题目】某化学兴趣小组的同学,为了比较金属R与铁、铜的金属活动性强弱,进行如下探究活动:
[查阅资料]铁的活动性比铜强.
[进行猜想]对三种金属的活动性顺序做出如下猜想:
猜想一:R>Fe>Cu; 猜想二:_______________; 猜想三:Fe>Cu>R
[收集证据]为了验证哪一种猜想成立,甲、乙、丙三位同学分别展开实验探究.
主要操作 | 主要现象 | 实验结论 | |
甲 | 将打磨好的R丝插入盛有硫酸铜溶液的试管中 | ______________ | 猜想一 正确 |
乙 | 将粗细相同打磨好的R丝、铁丝,分别插入体积和溶质质量分数都相同的稀盐酸中 | R丝表面产生气泡速率比铁丝表面产生气泡速率___(填“快”或“慢”) | |
丙 | 将粗细相同打磨好的R丝、铁丝,分别在空气中点燃 | R丝在空气中剧烈燃烧,铁丝在 空气中______ |
写出铁丝在氧气中燃烧的化学方程式__________________________________
[交流反思]三位同学交流讨论后认为,比较金属活动性强弱的方法有多种.
[归纳总结]他们总结得出比较金属活动性强弱的常见方法有:
(1)金属与氧气反应的难易和剧烈程度;
(2)金属与酸溶液是否反应或反应的剧烈程度;
(3)金属与_____是否反应.
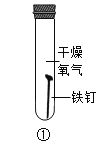
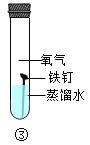
【题目】钢铁的锈蚀及其防护。
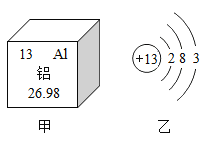
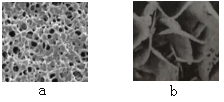
(1)“知锈”:铁锈通常为_____色固体,其微观结构可用下图中的_____反映,区分铁和铁锈的简单物理方法是_____。
(2)“探锈”:设计以下实验探究铁发生锈蚀的主要因素。
|
|
|
|
立即观察 | 不生锈 | 不生锈 | 不生锈 |
1天后 | 不生锈 | 不生锈 | 不生锈 |
3天后 | 不生锈 | 不生锈 | 表面有锈迹 |
1周后 | 不生锈 | 不生锈 | 锈蚀明显 |
实验时,试管②中的蒸水必经过煮沸,主要目的是_____。对比表格中的试管_____(填编号),可知水是铁锈蚀的因素之一。
(3)“防锈”:很多学校在校门口摆放的铁质防冲撞栏防锈的方法是_____。
(4)“用锈”:某食品脱氧剂可迅速将包装袋内的氧气浓度降到0.01%以下。该脱氧剂中除含有铁粉、活性炭、水等物质外,还含有能促进铁锈蚀的_____(填化学式)。
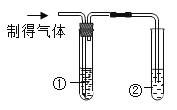
【题目】某化学兴趣小组同学用大理石和盐酸反应制取 CO2,将制得的气体通入新制的饱和澄清石灰水时,发现有气泡冒出,但一段时间后仍不变浑浊, 对此展开了探究活动 。
(提出问题)澄清石灰水未变浑浊的原因是什么?
(猜想与假设)I.制得气体中无 CO2 II.与盐酸的浓度有关
(进行实验)
实验1:小组同学取等量原试剂瓶中澄清石灰水于试管内进行实验
实验操作 | 现象 | 初步结论 |
| 试管1澄清石灰水未变浑浊 试管2澄清石灰水浑浊 | 可知猜想I不成立。 (1)写出试管中②发生的化学反应方程式_____ |
实验2:依据实验1结论,深入探究
实验序号 | ① | ② | ③ | ④ | ⑤ |
大理石质量(g) | 10 | 10 | 10 | 10 | 10 |
盐酸质量分数(%) | 37.5 | 20.3 | 13.9 | x | 8.5 |
盐酸体积(mL) | 10 | 10 | 10 | 10 | 10 |
将产生的气体通入5 mL新制饱和澄清石灰水中的现象 | 无 | 无 | 出现浑浊 | 出现浑浊 | 出现浑浊 |
实验3 :6个 125mL集气瓶中分别充入不同体积CO2 进行实验
实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
CO2体积(mL) | 5 | 25 | 50 | 75 | 100 | 125 |
加入5 mL饱和澄清石灰水振荡5次现象 | 澄清 | 变浑浊 | 变浑浊 | 变浑浊 | 变浑浊 | 变浑浊 |
振荡30次后现象 | 澄清 | 浑浊 | 浑浊 | 浑浊 | 澄清 | 澄清 |
(解释与结论)
(2)实验2的目的是_________。
(3)实验2表格中x的取值范围是________。实验2证明猜想II成立。
(4)分析实验3表格,你认为影响该实验现象的因素有_______。
(拓展)(5)查阅资料:碳酸钙的浊液能与二氧化碳反应生成能溶于水的碳酸氢钙(Ca(HCO3)2)写出⑥中从浑浊变澄清的化学方程式_______。