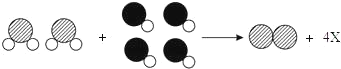
题目内容
【题目】某兴趣小组同学对甲烷燃烧的产物产生了兴趣,设计实验探究:
[提出问题]甲烷燃烧后生成哪些物质?
[猜想与假设]猜想一: CO2、H2O; 猜想二: CO、H2O;猜想三: CO2、 CO、H2O
[实验探究]将甲烷在一定量的纯净氧气中燃烧的产物依次通过下图装置进行验证:
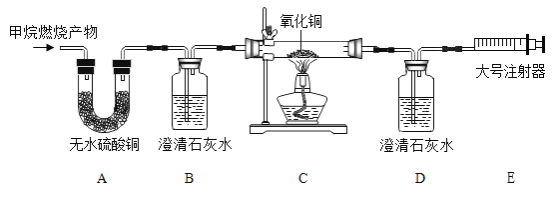
(1)能证明产物中有水蒸气存在的现象是_____。
(2)实验过程中,B装置的作用是_____;该反应的化学方程式是_____。
(3)甲同学认为,仅根据D中澄清石灰水变浑浊,无法确定一氧化碳的存在, 原因是_____。
(4)乙同学根据C中粉末由黑色变为红色,得出气体中存在一氧化碳, 该现象体现了一氧化碳的性质是_____。若0.1mol的氧化铜与足量的一氧化碳反应,求参加反应的一氧化碳的质量是_____,(利用化学方程式列式计算)。
(5)实验探究中用纯净氧气而不用空气的原因是_____。
(6)E处的大号注射器,可以引导气体流向,其另一个主要作用是_____。
[实验结论]经检验,猜想三成立。
【答案】装置A固体由白色变成蓝色 检验燃烧产物中是否含有二氧化碳 ![]() 使D中澄清石灰水变浑浊的二氧化碳可能是原混合气体中没有被除尽的二氧化碳 还原性 2.8g 空气中含有二氧化碳和水蒸气,影响燃烧产物的检验 收集尾气
使D中澄清石灰水变浑浊的二氧化碳可能是原混合气体中没有被除尽的二氧化碳 还原性 2.8g 空气中含有二氧化碳和水蒸气,影响燃烧产物的检验 收集尾气
【解析】
(1)无水硫酸铜遇水变成蓝色。装置A固体由白色变成蓝色,说明原混合气体中含有水蒸气;
(2)澄清石灰水遇二氧化碳变浑浊,常用澄清石灰水检验二氧化碳。实验过程中B装置的作用是检验燃烧产物中是否含有二氧化碳;二氧化碳能和氢氧化钙反应生成碳酸钙沉淀和水,该反应的化学方程式是:![]() ;
;
(3)使D中澄清石灰水变浑浊的二氧化碳可能是原混合气体中没有被除尽的二氧化碳,仅根据E中澄清石灰水变浑浊,无法确定一氧化碳的存在;
(4)一氧化碳与氧化铜反应生成铜和二氧化碳,过程中一氧化碳得到氧,体现了其还原性;
0.1mol氧化铜的质量为0.1mol×80g/mol=8g。
设参加反应的一氧化碳的质量是x 。
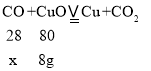
![]() x=2.8g。
x=2.8g。
答:参加反应的一氧化碳的质量是2.8g.
(5)实验探究中用纯净氧气而不用空气的原因是空气中含有二氧化碳和水蒸气,影响燃烧产物的检验;
(6)F处的大号注射器,可以引导气体流向,其另一个主要作用是收集尾气(或贮存气体),防止空气污染。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】化学兴趣小组为验证质量守恒定律,他们在老师指导下,做了镁条在空气中燃烧的实验。
(1)写出镁条与氧气反应的化学方程式:_____。
(2)小华发现燃烧所得固体的质量大于消耗的镁条质量,他据此认为该反应不遵循质量守恒定律。你_____(同意”或“不同意”)小华的观点,理由是_____。
(3)小红按如图装置进行实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。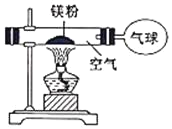
(提出问题)黄色固体是什么物质?
(查阅资料)①镁与氮气反应生成黄色的氮化镁(Mg3N2)固体;②氮化镁可与水剧烈反应产生氨气。
(做出猜想)黄色固体为氮化镁。
(实验探究)请你设计实验,验证猜想:
实验操作 | 实验现象 | 实验结论 |
取足量的黄色固体加入试管,然后滴入适量的_____,并将_____放在试管口 | _____ | 猜想正确 |
(反思与交流)
①通过上述探究活动,你对燃烧有什么新认识:_____。
②空气中氮气的含量远大于氧气的含量,而镁条在空气中燃烧生成的氧化镁却远多于氮化镁,这是因为_____。