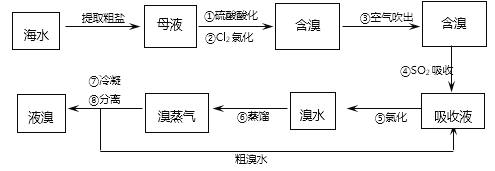
题目内容
【题目】碳酸钙可以作牙膏中的摩擦剂,下图是用石灰石制备高纯度碳酸钙的流程图。回答下列问题:
(1)操作①所用的玻璃仪器为__________(填一种即可)。
(2)步骤②属于_______(填“放热”或“吸热”)反应。
(3)写出步骤①中反应的化学方程式_________。
(4)步骤③中使用饱和石灰水,若将接近饱和的石灰水变成饱和溶液,下列方法可行的是___________(填序号)。
①加入生石灰 ②加入氢氧化钙 ③升高温度 ④降低温度
【答案】 玻璃棒(或烧杯、漏斗) 放热 ![]() ①②③
①②③
【解析】(1)根据过滤操作所用的仪器分析解答;(2)根据生石灰与水反应放出大量的热解答;(3)根据碳酸钙在高温的条件下分解生成氧化钙和二氧化碳解答;(4)根据饱和溶液与不饱和溶液相互转化的方法结合氢氧化钙的溶解度分析解答。(1)过滤所用的玻璃仪器包括玻璃棒、烧杯和漏斗(任填一个即可);(2)生石灰与水反应放出大量的热,故步骤②属于放热反应;(3)碳酸钙在高温的条件下分解生成氧化钙和二氧化碳,反应的化学方程式CaCO3高温CaO+CO2↑;(4)氢氧化钙的溶解度随温度的升高而降低。将接近饱和的石灰水变成饱和溶液,可采取的方法有增加溶质(即加入氢氧化钙或者加入生石灰。因为生石灰与水反应生成氢氧化钙。)、升高温度。故选①②③。

练习册系列答案
相关题目