题目内容
【题目】已知:镁在空气中燃烧生成氧化镁和氮化镁(Mg3N2),氮化镁与水反应生成氢氧化镁和氨气。
(1)写出氮化镁与水反应的化学方程式 ;
(2)a 克镁在空气中完全燃烧生成固体的总质量m为 ;(用含a 的式子表示m 的取值范围)
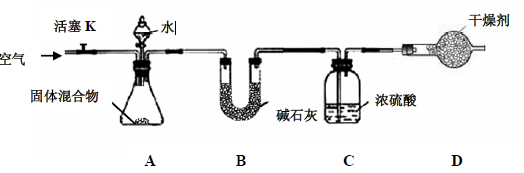
(3)某学生对该混合物中氮化镁的质量分数进行测定,设计如下实验装置
【查阅资料】
I.碱石灰是固体氧化钙和氢氧化钠的混合物,常用作干燥剂,不与NH3 反应。
II.2NH3+H2SO4 = (NH4)2SO4
III.NH3 是一种极易溶于水的气体。
【实验步骤】①检查装置的气密性;②精确称量镁在空气中燃烧后的固体5.00g 放入锥形
瓶中,称量装置C,连接好装置;③关闭活塞K,打开A 中分液漏斗活塞,逐滴加入水,
至样品恰好完全反应;④打开活塞K,鼓入空气;⑤再次称量装置C,装置C 增重0.34g。
请回答:
(一)装置B 的作用是 ;
(二)装置D 的作用是 ;
(三)实验步骤④中鼓入空气的目的是 ;
(四)固体混合物中Mg3N2 的质量分数为 ;
(五)实验证明此方法测定的结果偏低,可能原因是 (写一条)
【答案】(1)Mg3N2 +6H2O == 3Mg(OH)2 +2NH3 ↑;(2)1.39a<m<1.67
(3)干燥;防止空气中的水蒸汽进入C装置;使产生的氨气完全被浓硫酸吸收;20%;有部分氨气溶于水
【解析】
试题分析:(1)根据描述,氮化镁与水反应生成氢氧化镁和氨气,故反应的化学方程式为:
Mg3N2 +6H2O == 3Mg(OH)2 +2NH3 ↑;
(2)镁在空气中燃烧可能生成氧化镁,也可能生成氮化镁,还可能是两者的混合物,利用化学方程式,根据反应的质量比可分别计算出镁与氮气反应生成的氮化镁,镁与氧气反应生成的氧化镁的质量。a 克镁在空气中完全燃烧生成固体的总质量m就在两者之间;
(3)(一)浓硫酸是常用的干燥剂,用于干燥气体;
(二)氮化镁与水反应生成氢氧化镁和氨气,该实验是通过测定氨气与浓硫酸反应增重的质量得到氨气的质量,从而计算出氮化镁的质量。故D装置的作用是防止空气中的水蒸汽进入C装置中,导致实验结果出现误差;
(三)实验步骤④中鼓入空气的目的是使氨气完全进入C装置,使氨气完全反应;
(四)装置C 增重0.34g,说明氮化镁与水反应生成的氨气的质量为0.34g,利用化学方程式,根据反应的质量比即可计算出氮化镁的质量;
设氮化镁的质量为x,那么:
Mg3N2 +6H2O == 3Mg(OH)2 +2NH3 ↑
100 34
X 0.34g
100/34 =x/0.34g
X=1g
固体混合物中Mg3N2 的质量分数=1g/5g ×100%=20%
(五)氮化镁与水反应生成的氨气易溶于水,故可能有部分氨气溶于水,导致测定的氨气的质量偏小,计算出的氮化镁的质量偏小。

 快捷英语周周练系列答案
快捷英语周周练系列答案