题目内容
仓库中有一包氮肥的包装标签模糊不清,有同学进行了以下探究:
(1)操作③用玻棒搅拌的目的是 。
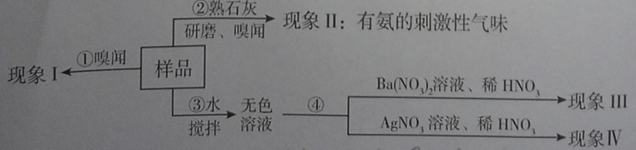
(2)请完成下表(已知AgCl和BaSO4是难溶于水和酸的白色固体):
(3)若现象Ⅲ、Ⅳ都无现象,则该氮肥可能是___________(写化学式);若操作②现象为无气味、现象Ⅲ、Ⅳ无现象,则该氮肥可能是 (只写一种)。
(1)操作③用玻棒搅拌的目的是 。

(2)请完成下表(已知AgCl和BaSO4是难溶于水和酸的白色固体):
| | 假设和现象 | 判断和化学方程式 |
| a | 若现象I为无氨味。 | 则样品中不含________________(填名称)。 |
| b | 由操作②现象判断。 | 该样品一定含有__________离子。 |
| c | 若现象Ⅲ为白色沉淀,现象Ⅳ为无沉淀。 | 则样品中含有 (写名称),该反应的化学方程式为 。 |
| d | 若现象Ⅲ为“无沉淀”,现象Ⅳ为白色沉淀。 | 则样品中含有 (写化学式),该反应的化学方程式为 。 |
(3)若现象Ⅲ、Ⅳ都无现象,则该氮肥可能是___________(写化学式);若操作②现象为无气味、现象Ⅲ、Ⅳ无现象,则该氮肥可能是 (只写一种)。
(1) 使样品充分溶解 (2) a.碳酸氢铵 b.铵根 c.硫酸铵 (NH4)2SO4 + Ba(NO3)2 =BaSO4↓+ 2NH4NO3
d. NH4Cl NH4Cl + AgNO3 = AgCl↓+ NH4NO3 (3) NH4NO3 尿素
d. NH4Cl NH4Cl + AgNO3 = AgCl↓+ NH4NO3 (3) NH4NO3 尿素
(1)氮肥都是易溶于水的,溶解时搅拌的目的是加快溶解;
(2)碳酸氢铵常温下能分解出氨气,可闻到氨气的刺激性气味,如果现象Ⅰ中无氨味,说明样品不含碳酸氢铵;铵盐与碱反应产生氨气,根据操作②加熟石灰研磨有氨的刺激性气味,说明样品中含铵离子;样品加水溶解后加入硝酸钡溶液有不溶于稀硝酸我白色沉淀生成,说明样品中含硫酸根离子,即含硫酸铵,样品溶液中加入硝酸银溶液无明显现象,说明样品溶液中不含氯离子,样品中不含氯化铵;如果样品溶液中加入硝酸银溶液有不溶于稀硝酸的白色沉淀,加入硝酸钡溶液无明显现象,说明样品溶液中含有氯离子,样品中含有氯化铵,氯化铵与硝酸银反应生成氯化银沉淀和硝酸铵;ⅡⅢⅣⅤ
(3)如果操作②中有氨味,样品溶液中加硝酸钡和硝酸银溶液均无明显现象,说明溶液中的阴离子只有硝酸根离子,即该氮肥可能是硝酸铵,如果操作操作②中无氨味,说明该氮肥不是铵盐,样品溶液中加硝酸钡和硝酸银溶液均无明显现象,则很可能是常见氮肥中的尿素。
(2)碳酸氢铵常温下能分解出氨气,可闻到氨气的刺激性气味,如果现象Ⅰ中无氨味,说明样品不含碳酸氢铵;铵盐与碱反应产生氨气,根据操作②加熟石灰研磨有氨的刺激性气味,说明样品中含铵离子;样品加水溶解后加入硝酸钡溶液有不溶于稀硝酸我白色沉淀生成,说明样品中含硫酸根离子,即含硫酸铵,样品溶液中加入硝酸银溶液无明显现象,说明样品溶液中不含氯离子,样品中不含氯化铵;如果样品溶液中加入硝酸银溶液有不溶于稀硝酸的白色沉淀,加入硝酸钡溶液无明显现象,说明样品溶液中含有氯离子,样品中含有氯化铵,氯化铵与硝酸银反应生成氯化银沉淀和硝酸铵;ⅡⅢⅣⅤ
(3)如果操作②中有氨味,样品溶液中加硝酸钡和硝酸银溶液均无明显现象,说明溶液中的阴离子只有硝酸根离子,即该氮肥可能是硝酸铵,如果操作操作②中无氨味,说明该氮肥不是铵盐,样品溶液中加硝酸钡和硝酸银溶液均无明显现象,则很可能是常见氮肥中的尿素。

练习册系列答案
相关题目


 验证猜想2
验证猜想2 验证猜想3
验证猜想3
