题目内容
【题目】实验是科学探究的重要途径。
(1)结合下列化学实验装置,回答有关问题。
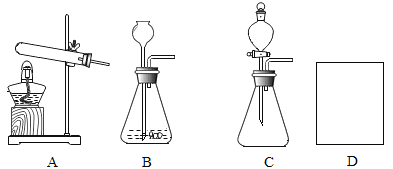
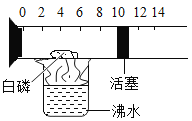
①写出一个用A装置制取O2的化学方程式_____。
②若用B装置制取能使澄清的石灰水变浑浊的气体,则实验室制取该气体的化学方程式是__。与B相比较,C的主要优点是什么______。
③用试管采用排空气法收集氢气,请在D方框中画出装置图(只画试管和导气管)______。
(2)用实验室存放的氢氧化钠溶液做中和反应实验,发现有气泡产生。于是红红判断氢氧化钠变质了。请用化学方程式说明氢氧化钠变质的原因______。
为探究氢氧化钠是否完全变质,红红设计了两个实验方案。
方案1:取少量上述氢氧化钠溶液样品,滴加几滴酚酞溶液,溶液变成红色
方案2:取少量上述氢氧化钠溶液样品,加入饱和石灰水,静置,取上层清液,滴加几滴酚酞溶液。发现溶红色。于是明明认为样品中还会有氢氧化钠,没有完全变质。
①康康认为红红的两个实验方案都不能达到目的,他的理由是____。
②请你设计一个方案来验证氢氧化钠是否完全变质。______。
(3)工业上常用氢氧化钠来中和废水中的盐酸,现取废液50g,逐滴滴入10%的氢氧化钠溶液中和,当溶液pH为7时,用去氢氧化钠溶液8g。请计算废水中氯化氢的质量分数__。
【答案】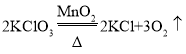
![]() 可以控制反应速度
可以控制反应速度 ![]()
![]() 方案1中,碳酸钠溶液也能使酚酞溶液变红,方案2中碳酸钠与氢氧化钙反应的生成物是氢氧化钠,也能使酚酞溶液变红 取少量上述氢氧化钠溶液样品,加入足量氯化钙溶液(或氯化钡溶液等),静置,取上层清液滴加几滴酚酞溶液,若溶液变成红色,则氢氧化钠没有完全变质;若溶液没有变成红色,则氢氧化钠全部变质 1.46%
方案1中,碳酸钠溶液也能使酚酞溶液变红,方案2中碳酸钠与氢氧化钙反应的生成物是氢氧化钠,也能使酚酞溶液变红 取少量上述氢氧化钠溶液样品,加入足量氯化钙溶液(或氯化钡溶液等),静置,取上层清液滴加几滴酚酞溶液,若溶液变成红色,则氢氧化钠没有完全变质;若溶液没有变成红色,则氢氧化钠全部变质 1.46%
【解析】
(1)①用A装置制取氧气,由于试管口没有塞一团棉花,应该是利用氯酸钾和二氧化锰制取,氯酸钾在二氧化锰的催化以及加热条件下生成了氯化钾和氧气,反应的化学方程式: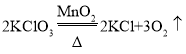 。故填:
。故填: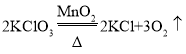 。
。
②能使澄清石灰水变浑浊的气体是二氧化碳,实验室用的药品为大理石和稀盐酸,大理石和稀盐酸反应生成氯化钙、水以及二氧化碳,反应的化学方程式是:![]() ,与B与C的的不同之处主要是一个是长颈漏斗一个是分液漏斗,分液漏斗能够控制液体药品流量,从而控制反应速率,所以与B相比较,C的主要优点是可以控制反应速率。故填:
,与B与C的的不同之处主要是一个是长颈漏斗一个是分液漏斗,分液漏斗能够控制液体药品流量,从而控制反应速率,所以与B相比较,C的主要优点是可以控制反应速率。故填:![]() ;可以控制反应速率。
;可以控制反应速率。
③用试管采用排空气法收集氢气,由于氢气密度比空气小,应该用向下排空气法收集,如图所示:![]() ,故填:
,故填:![]() 。
。
(2)氢氧化钠变质,是因为能和空气中的二氧化碳反应生成碳酸钠和水,反应的化学方程式:![]() ,故填:
,故填:![]() 。
。
①康康认为红红的两个实验方案都不能达到目的,他的理由是碳酸钠溶液显碱性,也能使酚酞试液变红色,碳酸钠和氢氧化钙反应生成氢氧化钠,影响对氢氧化钠的检验。故填:方案1中,碳酸钠溶液也能使酚酞溶液变红,方案2中碳酸钠与氢氧化钙反应的生成物是氢氧化钠,也能使酚酞溶液变红。
②要证明氢氧化钠是否完全变质只需证明样品中是否还存在氢氧化钠即可,但是验证有没有氢氧化钠存在时注意要将碳酸钠完全除尽,防止对氢氧化钠的检验造成干扰,因此可取少量上述氢氧化钠溶液样品,加入足量氯化钙溶液(或氯化钡溶液等),静置,取上层清液滴加几滴酚酞溶液,若溶液变成红色,则氢氧化钠没有完全变质;若溶液没有变成红色,则氢氧化钠全部变质。故填:取少量上述氢氧化钠溶液样品,加入足量氯化钙溶液(或氯化钡溶液等),静置,取上层清液滴加几滴酚酞溶液,若溶液变成红色,则氢氧化钠没有完全变质;若溶液没有变成红色,则氢氧化钠全部变质。
(3)设废水中稀盐酸中溶质的质量为x。
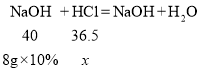
![]()
x=0.73g
废水中氯化氢的质量分数是![]()
答:废水中氯化氢的质量分数是1.46%。

【题目】某化学兴趣小组将光亮铜片放在酒精灯火焰上灼烧,发现表面变黑,他们对黑色物质来源产生了兴趣,对铜片表面黑色物质的成分进行探究:
(查阅资料)(1)酒精不充分燃烧产生炭黑(即烟灰);
(2)氧气的化学性质比较活泼,加热条件下能与金属铜反应生成黑色的氧化铜。
(猜想与假设)
甲认为: ____________。
乙认为:铜片表面的黑色固体是空气中的氧气与铜反应生成的新物质。
丙认为:铜片表面的黑色固体既有烟灰又有氧气与铜反应生成的新物质。
(进行实验)
实验步骤和方法 | 实验现象 | 实验结论 |
实验一:取一小段光亮铜片,放入试管内,然后用试管夹夹持试管,放在酒精灯的外焰部位加热。 | 铜片变黑 | 甲、丙的猜想错误。说明黑色物质的出现可能与空气中的________有关。 |
实验二:取一试管,将一小段光亮铜片放入试管中,塞上胶塞,并用注射器抽出试管内的空气,封好胶塞,并加热,趁热取下胶塞,观察现象。 | 取下胶塞前的现象: _____。取下胶塞后的现象:___。 | 乙的猜想正确 |
(反思拓展)
(1)实验一将铜片放入试管中加热,目的是排除了______的干扰。
(2)实验二用注射器抽出试管内空气的目的是________。
(3)通过对黑色物质来源的探究,写出金属铜与氧气反应的化学方程式_____。