题目内容
【题目】计算题:
(1)已知葡萄糖的化学式为C6H12O6,则①葡萄糖中C、H、O三种元素质量比为_______。
②36g葡萄糖中所含氢元素与________g水中所含氢元素质量相等。
(2)若规定以氧原子质量的1/16作为相对原子质量的标准,已知一个NO2分子质量为ag,一个N2O5分子质量为bg,则N2O4的相对分子质量为____________(用含a、b的式子表示)。
(3)某种胃药的主要成分可用MgaAlb(OH)x(CO3)y表示,请用一个等式表示a、b、x、y之间的关系_____。
(4)1吨下述氮肥的市场价格如下:①CO(NH2)2:1200元;②NH4NO3:810元 ③NH4HCO3 :330元,分别用1万元采购上述氮肥,则得到的氮元素质量由多到少顺序为_______(填序号)。
(5)已知乙醇(C2H5OH)与水的混合物中,水的质量分数为54%,则该混合物中乙醇分子与水分子的个数比______________。
【答案】6:1:8; 21.6 32a/b-2a 2a+3b-x-2y=0 ③②① 1:3
【解析】
(1)①根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,计算解答;
②根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,计算解答;
(2)根据相对原子质量的求法,进行分析求出NO的相对分子质量;
(3)根据化合物中各元素化合价的代数和为0确定这几个字母之间的关系;
(4)让三种化肥提供一样多的N元素,求出四种化肥的质量比,然后根据单价,根据计算用钱的多少排序;
(5)设乙醇与水的混合物的质量为100g,分别计算出水的质量和乙醇的质量,然后再计算出分子个数之比。
(1)①葡萄糖中碳、氢、氧三种元素的质量比(12×6):(1×12):(16×6)=6:1:8;
②设与36g葡萄糖中所含氢元素的质量相等的水的质量为x。
36g×![]() ×100%=
×100%=![]() ×100%×x
×100%×x
x=21.6g;
(2)因1个N2O5分子比2个NO2多1个氧原子,所以其质量差恰好为1个氧原子的质量,也就是(b-2a)kg。相对原子质量的标准(即氧原子质量的1/16)是:![]() 。1个N2O4分子的质量恰好就是2个NO2分子的质量,根据求某原子的相对原子质量的方法,该物质的相对分子质量为:
。1个N2O4分子的质量恰好就是2个NO2分子的质量,根据求某原子的相对原子质量的方法,该物质的相对分子质量为: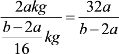 ;
;
(3)化合物中各元素化合价的代数和为0,所以(+2a)+(+3b)+(-1×x)+(-2y)=0,则2a+3b-x-2y=0;
(4)提供一样多的N元素(从分子的角度考虑,都提供2个N原子),三种化肥的质量比为:
CO(NH2)2------NH4NO3------2NH4HCO3
60: 80:158
30: 40:79
该质量比的化肥用钱数之比为30×1200:40×810:79×330
36000:32400:26070
通过比较,提供一样多的N元素,购买NH4HCO3花钱最少,购买CO(NH2)2花钱最多。那么花一样多的钱,购买NH4HCO3所含N元素最多,购买CO(NH2)2所含N元素最少。故分别用1万元采购上述氮肥,则得到的氮元素质量由多到少顺序为③②①;
(5)设乙醇与水的混合物的质量为100g,则混合物中水的质量=100g×54%=54g,乙醇的质量=100g-54g=46g。该混合物中乙醇分子与水分子的个数比为:![]() 。
。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】为了帮助同学们更好的理解空气中氧气含量测定的实验原理,老师利用传感器技术实时测定了实验装置(如图1)内的压强、温度和氧气浓度,三条曲线变化趋势如图2所示。
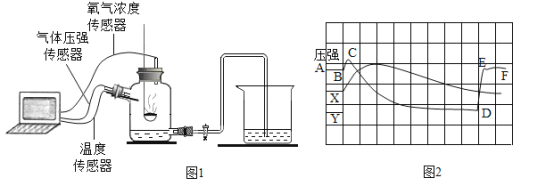
(1)红磷燃烧的化学方程式为 __;
(2)X曲线表示的是 _____(填“温度”或“氧气的浓度”);
(3)结合X、Y两条曲线,解释图2中BC段气压变化的原因是_____ ;
(4)实验中测得的数据如下:
测量 项目 | 实验前 | 实验后 | |
烧杯中水的体积 | 烧杯中剩余水的体积 | 瓶中剩余气体的体积 | |
体积/mL | 80.0 | 46.4 | 126.0 |
根据实验数据计算:测得的空气中氧气的体积分数为______(列出计算式即可)。