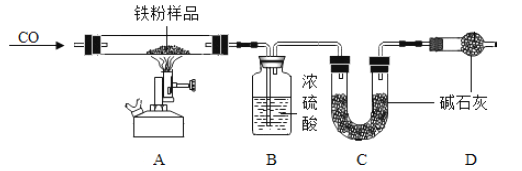
��Ŀ����
����Ŀ��ij��ѧ��ȤС�������һϵ��̽���������һͬ���룮
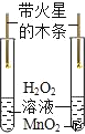
��̽��һ������˿ȼ���Ƿ���Ҫ����
��ʵ�����ݣ���ȡ0.38mm����˿���ֱ����������Ϊ90%��70%��60%��55%��O2��ʵ�飮
��ʵ������
O2% | 90% | 70% | 60% | 55% |
ʵ������ | ȼ�վ��ҡ�ȼ��ʱ�䳤��Ч���� | ȼ�ձ�90%����ȼ��ʱ��̣�ʵ��ɹ� | ȼ�ձ�70%����ȼ��ʱ����̣�ʵ��ɹ� | ����ȼ�գ�ֻ�Ƿ��� |
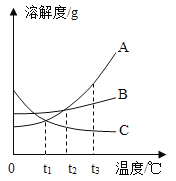
�����ۣ�����0.38mm��˿���ԣ�ȼ����������������������Ϊ_____��������Ũ��Խ��ȼ������Խ_____��������ҡ������ҡ�����
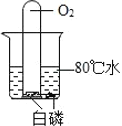
��̽����������˿ȼ�ղ������������ԭ��
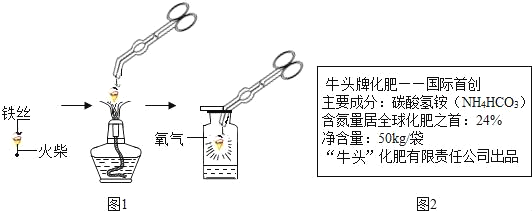
��1����ͼ������״��˿��ĩ��ϵһ������������_____��
��2��С������ͼʵ��ʱ������ƿը���ˣ�����ܵ�ԭ����_____��
��3��С������˿��������ȼ��Ϊʲô������������̽�����±�����������˿�Ͳ�ͬ��̼������˿����˿ֱ��Ϊ0.4mm������������ȼ��ʱ��ʵ������ļ�¼�������������±���
���� | ����˿ | ��̼0.05%����˿ | ��̼0.2%����˿ | ��̼0.6%����˿ |
ȼ��ʱ ������ | ������������ �۶� | ����ȼ�� ���ٻ��� | ����ȼ�� �������� | _____ |
ͨ������ʵ�飬˵����˿ȼ�ղ����������������_____����Ԫ�ط��ţ��йأ�
��̽����������������ij�Ӷ�ˮ��Դ����״��
��1��Ϊ�˱��������ˮ�ʣ����������������ǣ�����ţ�_____��
A ����ˮ�����ж���ֲ������� B �������ŷŹ�ҵ��ˮ
C ��ֹʹ��ũҩ�ͻ��� D ������ˮ�����ŷ�
��2���о��ճ������н�Լ��ˮ��һ�ַ�����_____��
��3��ˮ��Ӳ����һ����Ҫ�Ļ�ѧָ�꣮�ճ��������������Ӳˮ����ˮ��_____��
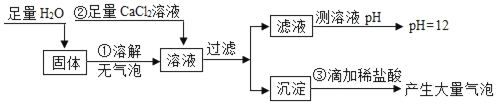
��4������ʩ�ò���������ˮԴ��Ⱦ��ԭ��֮һ�����DZ���ѧ���ѧʩ�ʵķ�����ij����̼����泥�NH4HCO3�� ���ʵ���ҵ������һ����ͼ��ʾ�Ĵ��ͻ����森
���������Ϣ�ش��������⣺
������ͨ�����㣨д��������̣��жϸù���Ƿ�������ٹ�棺_____
�����������ල���ż�ⷢ�ָû��ʵĺ�����Ϊ17.5%��������NH4HCO3����������Ϊ_____��
���𰸡���55% ���� ����������ȼ��˿ û���ڼ���ƿ�ڷ�������ˮ��ϸɳ ����ȼ�գ��������� C B ������ˮ���� ȡ��֧�Թֱܷ��������Ӳˮ����ˮ��Ȼ�����Թ��зֱ����2��3�η���ˮ����ĭ�������ˮ����ĭ�ٵ���Ӳˮ ����к�����Ϊ24%������̼������еĺ�����17.7%������Ϊ��ٹ�� 98.87%
��������
̽��һ����ͼ����֪��0.38mm��˿���ԣ�ȼ����������������������Ϊ����55%������Ũ��Խ��ȼ������Խ���ң������55%������
̽��������1��ͼ1������״��˿��ĩ��ϵһ����������������������ȼ��˿���������������ȼ��˿��
��2����ͼ1ʵ��ʱ������ƿը���ˣ�����ܵ�ԭ����û���ڼ���ƿ�ڷ�������ˮ��ϸɳ��ȼ�����ɵĸ��¹�������ը�Ѽ���ƿ�����û���ڼ���ƿ�ڷ�������ˮ��ϸɳ
��3����ͼ����֪����˿ȼ�ղ����������������̼Ԫ�غ����й��Ҷ�0.2mm����˿���ԣ���̼��Խ�ߣ�������������Խ���ԣ��������ȼ�գ��������䣻C
̽��������1������ˮ�����ж���ֲ�����������ֹʹ��ũҩ�ͻ��ʣ���Ȼ�ɱ���ˮ�ʵ�ȴ�Dz�����ʵʩ�ľٴ룬�ʲ�������������ˮ�����ŷŻ���Ⱦˮ��Դ���������������������ŷŹ�ҵ��ˮ���ǿ��еı���ˮ�ʵĺ������������B
��2����Լ��ˮ�����������࣬��һˮ���ã�������ˮ��������ϴ�·���ˮ������ȣ�����ˮ��ʱ�ر�ˮ��ͷ��ʹ�ý�ˮ��ͷ����ҵ����ˮ����������ѭ��ʹ�á�ũҵ�ϸı��ȵķ�ʽ�������м�ǿ��Լ��ˮ����ʶ�����������ˮ����
��3������Ӳˮ����ˮ����Ҫ�������÷���ˮ������ĭ�������ˮ����ĭ�ٵ���Ӳˮ�����ȡ��֧�Թֱܷ��������Ӳˮ����ˮ��Ȼ�����Թ��зֱ����2��3�η���ˮ����ĭ�������ˮ����ĭ�ٵ���Ӳˮ
��4����̼������е�Ԫ�ص���������Ϊ��![]() ��100%��17.7%������к�����Ϊ24%������̼������еĺ�����17.7%������Ϊ��ٹ�棻�������к�����Ϊ24%������̼������еĺ�����17.7%������Ϊ��ٹ��
��100%��17.7%������к�����Ϊ24%������̼������еĺ�����17.7%������Ϊ��ٹ�棻�������к�����Ϊ24%������̼������еĺ�����17.7%������Ϊ��ٹ��
��NH4HCO3������������![]() ��100%��98.87%�����98.87%
��100%��98.87%�����98.87%

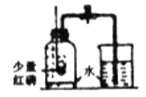
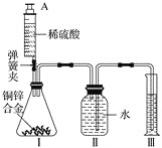
����Ŀ����һ֧�Թ��з���һС��þ��(�Ѳ�ȥ����Ĥ)�������Թ��м���һ���������ᣬþ��������_____��������Ӧ�Ļ�ѧ����ʽ��_____��
[��������]Ϊ���ٴι۲�������Ӧ����С��ͬѧ�ýϳ���þ����������ʵ�飬���������쳣�����Թ��г����˰�ɫ������
[ʵ����֤1]С��ͬѧ�������ʵ��IJ�ͬ����ƶԱ�ʵ�鷽����̽�������쳣�����ԭ��
[�ó�����]þ�������ᷴӦ������ɫ������_____�йء�
[��]��ɫ������ʲô���ʣ�
[��������]��20 ��ʱ��100 gˮ��������ܽ��Ȼ�þ54.8 g��
��þ������ˮ��Ӧ����һ�ּ��������
���Ȼ����Ȳ�����ˮҲ������ϡ���ᡣ
[��������]����һ��þ����������Ȼ�þ����������������þ�������������_____(�û�ѧ����ʽ��ʾ)��
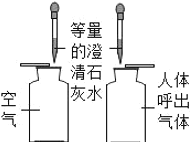
[ʵ����֤2]����ɫ����ϴ�Ӹɾ����ֱ�ȡ����������A��B��C�Թ��У��������ʵ�飺
�Թ� | ���� | ���� | ���� |
A | ������������ | _____����ɫ����_____ | ����һ����ȷ�������ְ�ɫ�������������� |
B | ��������ˮ | ��ɫ����_____ | ���������ȷ |
C | ��������ϡ���� | ��ɫ������ʧ | ԭ��ɫ�����к��е������ǣ�Mg2+��_____ |
�����μӼ�����������Һ | ���ִ�����ɫ���� |