题目内容
(2013?海安县模拟)(1)根据下图回答问题:
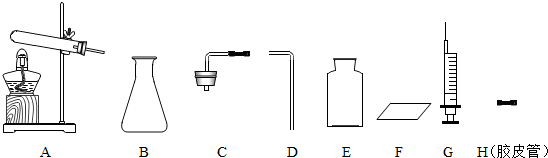
①小东同学选择上图中的B、C、D、E、F仪器制取氧气,则化学反应原理为
②小东在实验前先连接B、C仪器,然后将注射器G与C的胶皮管相连,再向外拉动注射器的活塞一段距离后松开活塞,发现注射器的活塞能回到原来的位置.他进行该步操作的目的是
③小明想利用反应2NaHCO3
Na2CO3+H2O+CO2↑制取少量二氧化碳气体,你认为他应该选择上图中的
(2)某实验小组的同学在加热铜与浓硫酸的混合物实验时,发现生成了一种无色有刺激性气味的气体和蓝色溶液,进行如下探究活动.
[查阅资料]①铜能与一些强氧化性的酸(如浓硫酸、硝酸等)发生反应,生成水、气体和铜盐.②硫酸铜溶液呈酸性.③二氧化硫与高锰酸钾溶液反应并使其褪色.
[探究一]铜与浓硫酸反应生成的气体是什么?
[猜想分析]小兰认为生成的气体可能是氢气或氧气.小芳马上予以否定,她的理由是
[实验论证]她们将生成的气体通入稀的高锰酸钾溶液,看到
[探究二]铜与浓硫酸反应得到的蓝色溶液是什么?
[分析讨论]①对于生成的蓝色溶液,小强认为可能是Cu(NO3)2溶液,小楠认为不可能是Cu(NO3)2溶液,而可能是硫酸铜溶液,小楠的理由是
②根据分析写出铜与浓硫酸共热的化学方程式
③小吉根据化学方程式说,该方法适用于以铜为原料大量制取硫酸铜,小田认为不适宜,你能说出小田的一个理由吗
[探究三]上述反应后的蓝色溶液中有硫酸剩余吗?
[实验讨论]①小伟认为可向蓝色溶液中滴加硝酸钡溶液,观察有无沉淀产生,经大家讨论后,该方案被否定,你觉得否定该方案的理由是
②小亮同学提问:可以用石蕊试液来进行检验吗?你的答案和理由是
[意外发现]实验小组的同学将足量的铜和足量的浓硫酸置于容器中加热一段时间后,发现反应会逐渐变慢,最后反应竟然停止,你能帮他们说出反应停止的原因吗?

①小东同学选择上图中的B、C、D、E、F仪器制取氧气,则化学反应原理为
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
(用化学方程式表示)
| ||
②小东在实验前先连接B、C仪器,然后将注射器G与C的胶皮管相连,再向外拉动注射器的活塞一段距离后松开活塞,发现注射器的活塞能回到原来的位置.他进行该步操作的目的是
检查装置的气密性
检查装置的气密性
.③小明想利用反应2NaHCO3
| ||
ADEF
ADEF
(填仪器或装置的序号)组装一套发生和收集装置.(2)某实验小组的同学在加热铜与浓硫酸的混合物实验时,发现生成了一种无色有刺激性气味的气体和蓝色溶液,进行如下探究活动.
[查阅资料]①铜能与一些强氧化性的酸(如浓硫酸、硝酸等)发生反应,生成水、气体和铜盐.②硫酸铜溶液呈酸性.③二氧化硫与高锰酸钾溶液反应并使其褪色.
[探究一]铜与浓硫酸反应生成的气体是什么?
[猜想分析]小兰认为生成的气体可能是氢气或氧气.小芳马上予以否定,她的理由是
氢气或氧气是无色无味的气体
氢气或氧气是无色无味的气体
.经过仔细分析,她们认为该气体可能是二氧化硫.[实验论证]她们将生成的气体通入稀的高锰酸钾溶液,看到
高锰酸钾溶液褪色
高锰酸钾溶液褪色
现象,从而证实了生成的气体是二氧化硫.[探究二]铜与浓硫酸反应得到的蓝色溶液是什么?
[分析讨论]①对于生成的蓝色溶液,小强认为可能是Cu(NO3)2溶液,小楠认为不可能是Cu(NO3)2溶液,而可能是硫酸铜溶液,小楠的理由是
反应前后元素的种类不变
反应前后元素的种类不变
.②根据分析写出铜与浓硫酸共热的化学方程式
Cu+2H2SO4
CuSO4+2H2O+SO2↑
| ||
Cu+2H2SO4
CuSO4+2H2O+SO2↑
.
| ||
③小吉根据化学方程式说,该方法适用于以铜为原料大量制取硫酸铜,小田认为不适宜,你能说出小田的一个理由吗
生成的二氧化硫会污染环境
生成的二氧化硫会污染环境
.小田还设计了一个以铜和稀硫酸为原料制取硫酸铜的更好方案,该方案是铜和氧气反应生成氧化铜,然后将氧化铜与稀硫酸反应得到硫酸铜
铜和氧气反应生成氧化铜,然后将氧化铜与稀硫酸反应得到硫酸铜
.[探究三]上述反应后的蓝色溶液中有硫酸剩余吗?
[实验讨论]①小伟认为可向蓝色溶液中滴加硝酸钡溶液,观察有无沉淀产生,经大家讨论后,该方案被否定,你觉得否定该方案的理由是
硫酸铜中也含有硫酸根离子,也能和氯化钡溶液反应生成白色沉淀
硫酸铜中也含有硫酸根离子,也能和氯化钡溶液反应生成白色沉淀
.②小亮同学提问:可以用石蕊试液来进行检验吗?你的答案和理由是
不可以;因为硫酸铜溶液也是酸性的,也能使石蕊变红
不可以;因为硫酸铜溶液也是酸性的,也能使石蕊变红
.[意外发现]实验小组的同学将足量的铜和足量的浓硫酸置于容器中加热一段时间后,发现反应会逐渐变慢,最后反应竟然停止,你能帮他们说出反应停止的原因吗?
随着反应的进行,浓硫酸中溶质的质量分数逐渐变小,稀硫酸与铜不反应
随着反应的进行,浓硫酸中溶质的质量分数逐渐变小,稀硫酸与铜不反应
.分析:(1)①小东同学选择上图中的B、C、D、E、F仪器制取氧气,是用常温反应制取氧气,说明是用双氧水分解的方法制取氧气,据此解答;
②根据检查装置气密性的方法分析解答;
③小明想利用加热NaHCO3 的方法制取少量二氧化碳气体,属于固体加热型,据此选择所需仪器;
(2)[探究一]据氢气和氧气均是无色无味的气体进行解答;并据所给资料可知:二氧化硫与高锰酸钾溶液反应并使其褪色,据此分析解答;
[探究二]①化学反应前后元素的种类不变;
②据铜与浓硫酸反应原理书写方程式;
③二氧化硫有刺激性气味,是一种有毒气体,并根据铜可与氧气反应生成氧化铜,氧化铜可与稀硫酸反应生成硫酸铜分析解答;
[探究三]①根据硫酸铜也含有硫酸根离子,可与硝酸钡反应生成硫酸钡沉淀分析解答;
②硫酸铜溶于水后,溶液呈酸性;
③铜和浓硫酸反应生成水,随着反应进行,浓硫酸中溶质的质量分数逐渐变小,而稀硫酸与铜不反应,所以反应会逐渐终止.
②根据检查装置气密性的方法分析解答;
③小明想利用加热NaHCO3 的方法制取少量二氧化碳气体,属于固体加热型,据此选择所需仪器;
(2)[探究一]据氢气和氧气均是无色无味的气体进行解答;并据所给资料可知:二氧化硫与高锰酸钾溶液反应并使其褪色,据此分析解答;
[探究二]①化学反应前后元素的种类不变;
②据铜与浓硫酸反应原理书写方程式;
③二氧化硫有刺激性气味,是一种有毒气体,并根据铜可与氧气反应生成氧化铜,氧化铜可与稀硫酸反应生成硫酸铜分析解答;
[探究三]①根据硫酸铜也含有硫酸根离子,可与硝酸钡反应生成硫酸钡沉淀分析解答;
②硫酸铜溶于水后,溶液呈酸性;
③铜和浓硫酸反应生成水,随着反应进行,浓硫酸中溶质的质量分数逐渐变小,而稀硫酸与铜不反应,所以反应会逐渐终止.
解答:解:(1)①小东同学选择上图中的B、C、D、E、F仪器制取氧气,是用常温反应制取氧气,说明是用双氧水分解的方法制取氧气,反应方程式是2H2O2
2H2O+O2↑;
②小东在实验前先连接B、C仪器,然后将注射器G与C的胶皮管相连,再向外拉动注射器的活塞一段距离后松开活塞,发现注射器的活塞能回到原来的位置.他进行该步操作的目的是检查装置的气密性,防止装置漏气;
③小明想利用加热NaHCO3 的方法制取少量二氧化碳气体,属于固体加热型,所以应该选择A,二氧化碳的密度比空气大,可用向上排空气法收集,还需选择D直导管,集气瓶、玻璃片;
(2)[探究一]氢气和氧气均是无色无味的气体,而实验得到的气体具有刺激性气味,所以不可能是氢气或氧气;据所给资料可知:二氧化硫与高锰酸钾溶液反应并使其褪色,所以气体若是二氧化硫,则将生成的气体通入稀的高锰酸钾溶液,高锰酸钾溶液会褪色;
[探究二]①根据质量守恒定律中的元素种类在化学变化前后不变,生成的蓝色溶液是金属铜和浓硫酸反应生成,因此该蓝色溶液不可能时硝酸铜溶液;
②由于金属和浓硫酸在加热条件下生成水、二氧化硫和硫酸铜,方程式为:Cu+2H2SO4
CuSO4+2H2O+SO2↑;
③由于二氧化硫气体是一种有刺激性气味的有毒气体,是造成空气污染的主要气体之一,因此不能用金属铜和浓硫酸反应来制取大量的硫酸铜;铜可与氧气反应生成氧化铜,氧化铜可与稀硫酸反应生成硫酸铜,可利用此法进行制取硫酸铜;
[探究三]①由于硫酸铜中也含有硫酸根离子,也能和氯化钡溶液反应生成白色沉淀,因此不能用氯化钡溶液来验证硫酸溶液是否有剩余;
②根据提供的资料不难看出,硫酸铜溶液也是酸性溶液,也能使紫色石蕊试液变红,故该方案不开行;
②由于随着反应的进行,浓硫酸中的溶质越来越少,即浓硫酸逐渐的变成了稀硫酸,而稀硫酸和金属铜不反应,所以反应会越来越慢直至停止;
故答案为:(1)①2H2O2
2H2O+O2↑;
②检查装置的气密性;
③ADEF;
(2)[探究一]氢气或氧气是无色无味的气体;高锰酸钾溶液褪色;
[探究二]①反应前后元素的种类不变;
②Cu+2H2SO4
CuSO4+2H2O+SO2↑;
③生成的二氧化硫会污染环境;铜和氧气反应生成氧化铜,然后将氧化铜与稀硫酸反应得到硫酸铜;
[探究三]①硫酸铜中也含有硫酸根离子,也能和氯化钡溶液反应生成白色沉淀;
②不可以;因为硫酸铜溶液也是酸性的,也能使石蕊变红;
③随着反应的进行,浓硫酸中溶质的质量分数逐渐变小,稀硫酸与铜不反应.
| ||
②小东在实验前先连接B、C仪器,然后将注射器G与C的胶皮管相连,再向外拉动注射器的活塞一段距离后松开活塞,发现注射器的活塞能回到原来的位置.他进行该步操作的目的是检查装置的气密性,防止装置漏气;
③小明想利用加热NaHCO3 的方法制取少量二氧化碳气体,属于固体加热型,所以应该选择A,二氧化碳的密度比空气大,可用向上排空气法收集,还需选择D直导管,集气瓶、玻璃片;
(2)[探究一]氢气和氧气均是无色无味的气体,而实验得到的气体具有刺激性气味,所以不可能是氢气或氧气;据所给资料可知:二氧化硫与高锰酸钾溶液反应并使其褪色,所以气体若是二氧化硫,则将生成的气体通入稀的高锰酸钾溶液,高锰酸钾溶液会褪色;
[探究二]①根据质量守恒定律中的元素种类在化学变化前后不变,生成的蓝色溶液是金属铜和浓硫酸反应生成,因此该蓝色溶液不可能时硝酸铜溶液;
②由于金属和浓硫酸在加热条件下生成水、二氧化硫和硫酸铜,方程式为:Cu+2H2SO4
| ||
③由于二氧化硫气体是一种有刺激性气味的有毒气体,是造成空气污染的主要气体之一,因此不能用金属铜和浓硫酸反应来制取大量的硫酸铜;铜可与氧气反应生成氧化铜,氧化铜可与稀硫酸反应生成硫酸铜,可利用此法进行制取硫酸铜;
[探究三]①由于硫酸铜中也含有硫酸根离子,也能和氯化钡溶液反应生成白色沉淀,因此不能用氯化钡溶液来验证硫酸溶液是否有剩余;
②根据提供的资料不难看出,硫酸铜溶液也是酸性溶液,也能使紫色石蕊试液变红,故该方案不开行;
②由于随着反应的进行,浓硫酸中的溶质越来越少,即浓硫酸逐渐的变成了稀硫酸,而稀硫酸和金属铜不反应,所以反应会越来越慢直至停止;
故答案为:(1)①2H2O2
| ||
②检查装置的气密性;
③ADEF;
(2)[探究一]氢气或氧气是无色无味的气体;高锰酸钾溶液褪色;
[探究二]①反应前后元素的种类不变;
②Cu+2H2SO4
| ||
③生成的二氧化硫会污染环境;铜和氧气反应生成氧化铜,然后将氧化铜与稀硫酸反应得到硫酸铜;
[探究三]①硫酸铜中也含有硫酸根离子,也能和氯化钡溶液反应生成白色沉淀;
②不可以;因为硫酸铜溶液也是酸性的,也能使石蕊变红;
③随着反应的进行,浓硫酸中溶质的质量分数逐渐变小,稀硫酸与铜不反应.
点评:本题难度较大,主要考查了实验室制取气体的装置选取、反应原理等知识,及金属的有关的化学性质,能很好的培养学生分析资料、解决问题的能力.

练习册系列答案
相关题目
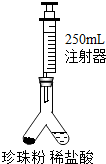 (2013?海安县一模)珍珠粉以其良好的养颜等功效,获得消费者喜爱.资料显示:珍珠中含碳酸钙80-93%、蛋白质4-14%、水份2-4%、十几种氨基酸、28种微量元素.然而一些不法分子用回收的贝壳加上工业用氢氧化钠配制的药水进行清洗、晾晒以后直接加工销售,其主要成分是:碳酸钙,及少量残留氢氧化钠.以下是某化学兴趣小组设计辨别真假珍珠,并测定珍珠中碳酸钙含量的实验探究方案.
(2013?海安县一模)珍珠粉以其良好的养颜等功效,获得消费者喜爱.资料显示:珍珠中含碳酸钙80-93%、蛋白质4-14%、水份2-4%、十几种氨基酸、28种微量元素.然而一些不法分子用回收的贝壳加上工业用氢氧化钠配制的药水进行清洗、晾晒以后直接加工销售,其主要成分是:碳酸钙,及少量残留氢氧化钠.以下是某化学兴趣小组设计辨别真假珍珠,并测定珍珠中碳酸钙含量的实验探究方案.