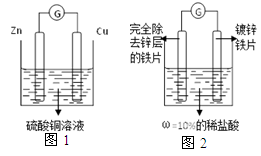
题目内容
“五一”假期,小兵对“锌与硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a.可能与硫酸的质量分数有关;b.可能与锌的形状有关。
【设计并实验】小兵用不同质量分数的硫酸和不同形状的锌进行如下实验。
| 实验编号 | 硫酸的质量分数(均取20mL) | 锌的形状(均取1g) | 氢气的体积(mL)(均收集3分钟) |
| | 20% | 锌粒 | 31.7 |
| | 20% | 锌片 | 50.9 |
| | 30% | 锌粒 | 61.7 |
| | 30% | 锌片 | 79.9 |
(1)写出稀硫酸与锌反应的化学方程式 。
(2)小兵用下图装置收集并测量氢气的体积,其中量筒的作用是 。

【收集证据】(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是 。
【得出结论】(4)结论是 。
【评价与反思】
(5)下表是小兵第①组实验的详细数据。
| 时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
请描述锌与硫酸反应的快慢的变化并解释原因 。
(6)锌与硫酸反应的快慢可能还受哪些因素影响? 。
(1)Zn + H2SO4 = ZnSO4 + H2↑
(2)通过测量排出水的体积,即产生氢气体积
(3)①③或②④
(4)硫酸的质量分数越大反应越快,锌片比锌粒反应快
(5)第1分钟反应慢,因为锌粒表面有氧化膜、油污等,覆盖在锌粒表面,从第2分钟以后,随着反应的进行,硫酸的质量分数减少,反应逐渐变慢
(6)温度或催化剂等
解析试题分析:(1)稀硫酸与锌反应的化学方程式:Zn + H2SO4 = ZnSO4 + H2↑
(2)装置的连接顺序是f→e→g,通过氢气将水排到量筒内,所以量筒的作用是通过测量排出水的体积,即产生氢气体积
(3)要比较不同质量分数的硫酸对反应快慢的影响,那就要控制其他的量要相同,所以选择①③或②④
(4)通过①③或②④比较,随着硫酸质量分数的增大,在3分钟内收集到的氢气体积也增多了,所以可以得出结论:硫酸的质量分数越大反应越快,通过①②或③④比较,可得出结论:锌片比锌粒反应快
(5)第1分钟反应慢,因为锌粒表面有氧化膜、油污等,覆盖在锌粒表面,从第2分钟以后,随着反应的进行,硫酸的质量分数减少,反应逐渐变慢
(6)影响锌与硫酸反应的快慢的因素很多;比如温度或催化剂等
考点:金属与酸反应速率快慢的影响因素的探究

明矾[化学式为KAl(SO4)2·12H2O]是一种常用的净水剂。小华同学为了探究明矾的净水原理,进行了如下实验探究:
【提出问题】明矾为什么能够净水?
【查阅资料】材料一:净水原理是,净水剂具有较大表面积或者净水剂粒子与水反应生成表面积较大的物质,把水中的细小漂浮颗粒吸附到表面,使其密度加大并下沉。
材料二:明矾[KAl(SO4)2·12H2O]在水溶液中可以解离出K+、Al3+、SO42-。
【提出猜想】猜想1:K+能与水反应产生表面积较大的物质。
猜想2:Al3+能与水反应产生表面积较大的物质。
猜想3:SO42-能与水反应产生表面积较大的物质。
猜想4:K+、Al3+、SO42-均能与水反应产生表面积较大的物质。
【完成实验】
| 实验 序号 | 水样(稍浑浊) 体积(mL) | 实验操作 | 观测 时间 | 实验现象 |
| ① | 20 | 向水样中加入KCl溶液 | 5分钟 | 仍浑浊 |
| ② | 20 | 向水样中加入Na2SO4溶液 | 5分钟 | 仍浑浊 |
| ③ | 20 | 向水样中加入Al2(SO4)3溶液 | 5分钟 | 变澄清 |
| ④ | 20 | 向水样中加入AlCl3溶液 | 5分钟 | 变澄清 |
【得出结论】实验 证明SO42-无净水作用,实验 证明K+无净水作用;
猜想 成立。
【交流反思】(1)小芳同学认为实验①和④是多余的,你 (填“支持”或“不支持”)她的观点,理由是 。
(2) (填“能”或“不能”)把实验③省去。
(3)小莉同学联想到自来水的生产过程中会用到活性炭去除水中异味,他认为活性炭的作用原理与明矾相同,你同意她的观点吗?[注意:若答对本小题奖励4分,化学试卷总分不超过60分。]
(填“同意”或“不同意”),理由是 。
学习了氢氧化钠的性质之后,知道氢氧化钠溶液中含有H2O、Na+、OH-,能使无色酚酞试液变红色,某科技小组想进一步探究是哪一种粒子使无色酚酞试液变红色。
【提出猜想】猜想①:可能是H2O ;猜想②:可能是Na+;猜想③:可能是OH-。
【实验验证】
| 实验操作 | 实验现象 | 结 论 |
| ①用试管取少量蒸馏水,滴入1滴~2滴无色酚酞试液,振荡 | 试管内溶液仍为无色 | 水分子不能使无色酚酞试液变红色 |
| ②用试管取少量氯化钠溶液,滴入1滴~2滴无色酚酞试液,振荡 | | |
| ③用试管取少量氢氧化钠溶液,滴入1滴~2滴无色酚酞试液,振荡 | | |
【讨论反思】有同学认为猜想①不需要实验验证就可以排除,你认为该同学的理由是 。
某化学实验活动小组的同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验。参与他们进行的探究活动:
【提出问题】久置氢氧化钠固体的成分是什么?
【猜想与假设】
猜想Ⅰ:全部是NaOH;
猜想Ⅱ:全部是Na2CO3; 猜想Ⅲ: 。
【实验与探究】
(1)分析:暴露在空气中的氢氧化钠会变质,变质原因是(用化学方程式表示)______________________
(2)实验如下:
| 实验操作步骤 | 实验现象 | 结论及解释 |
| 步骤一:取少量固体样品于试管中,加蒸馏水完全溶解,然后加入足量的_________。 | 实验过程中始终没有气泡产生。 | 则证明猜想 成立。 |
| 步骤二:另取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加氯化钡溶液。 | 实验过程中产生 | 则证明猜想Ⅱ或Ⅲ成立。此过程中发生反应的化学方程式为 _____________________ |
(3)为了进一步的验证猜想结果,小明同学提出如下实验方案:继续步骤二的实验,过滤,然后向滤液中滴加无色酚酞试液,若酚酞变红,则猜想_________成立;若酚酞不变红,则猜想______成立。
小华同学立即对小明同学的方案提出了质疑,通过查阅资料知道,氯化钡溶液呈中性,不能使无色酚酞试液变红,但碳酸钠溶液呈 性(填“酸”或“碱”),能使酚酞变红,因此他认为该方案的操作步骤中应该改进的是 。
为区别NaOH和Na2CO3两种无色溶液,某同学设计了以下两种实验方案:
方案1:分别取少许两种溶液,各滴入几滴无色酚酞试液,根据酚酞试液是否变红色判断各是哪种溶液?
方案2:分别取少许两种溶液,各加入少量澄清石灰水,根据是否有白色沉淀生成判断各是哪种溶液?请回答:(1)该同学设计的两个方案有一个是正确的,该方案是 ;另一个方案是不正确的,原因是 。
(2)请你再设计一个实验,区别上述两种溶液:
| 实验操作 | 实验现象 | 实验结论和化学反应方程式 |
| | | |
四硫化钠(Na2S4)固体可替代红磷测定空气中氧气的体积分数,反应原理为:2Na2S4+O2+2H2O=8S↓+4NaOH
【查阅资料】①Na2S4受热时,会与空气中的水蒸气反应,生成少量有毒气体硫化氢。
②硫代硫酸钠(Na2S2O3)可溶于水,常温下与NaOH溶液不反应。
③NaOH溶液可吸收硫化氢和二氧化碳。
【实验过程】
①取0.5g碳酸钠、0.2g硫粉混合后置于试管中,加入(如图①所示,夹持装置已略去),制得Na2S4,反应为:4Na2CO3+12S+X 2Na2S4+2Na2S2O3+4CO2,X的化学式为 ;
2Na2S4+2Na2S2O3+4CO2,X的化学式为 ;
②冷却后,取下棉花,放置一段时间,再向该试管中加入10mL水,迅速塞紧橡胶塞,充分振荡。测量液面至橡胶塞下沿的距离,记录数据h1(如图②所示);
③将该试管插入水中(如图③所示),拔下橡胶塞,观察到 ,塞紧橡胶塞。将试管取出,倒转过来,测量液面至橡胶塞下沿的距离h2,记录数据h2。理论上h2:h1= ;
④按照①~③再重复实验2次。3次实验数据如下表所示。
| | 第1次 | 第2次 | 第3次 |
| h1/cm | 11.0 | 11.4 | 11.6 |
| h2/cm | 8.7 | 9.1 | 9.2 |
【解释与结论】根据第1次实验数据,计算空气中氧气的体积分数为 %(结果精确到0.1%);
【反思与评价】实验过程①中浓NaOH溶液的作用是 ;若实验过程②中,取下棉花后,未放置一段时间即进行后续操作,测定结果 (填“偏大”、“偏小”或“无影响”),理由是: 。(2分)