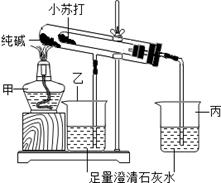
题目内容
(7分)下图为用镀锌铁片制成的日常用品。镀锌铁是指通过镀锌工艺在铁皮上进行镀锌而制成的一种产品,热镀锌产品广泛用于建筑、家电、车船、容器制造业、机电业等,几乎涉及到衣食住行各个领域。
为测定铁片镀锌层的厚度实验过程如下。
【实验步骤】
⑴ 剪取一片镀锌铁片,量得长度=2.0cm,宽度=1.9cm。
⑵ 用电子天平称量质量0.857g。
⑶ 实验中需要溶质质量分数为10%的稀盐酸200mL(密度=1.05g/mL),需要量取溶质质量分数为37%的浓盐酸(密度=1.18g/mL) mL(保留至小数点后1位),然后稀释。
⑷ 将镀锌铁片放入溶质质量分数为10%盐酸中。当观察到 ,可以判断镀锌层恰好反应。
⑸ 将溶液中的铁片取出清洗、擦干、烘干后用电子天平称量质量0.837g。
【计算结果】
⑴ 铁片镀锌层的质量有 g。
⑵ 已知锌的密度7.1g/cm3,计算出铁片镀锌层厚度mm(保留至小数点后2位)。
【实验反思】
实际计算结果偏大,同学们分析,这是因为很难通过观察现象判断镀锌层恰好反应,造成镀锌铁片浸泡在盐酸中时间 。(填“偏长”、“偏短”)
【实验改进】
资料卡片:如图1所示,两种金属活动性不同的金属放入酸碱盐溶液中,会有电子的流动,从而产生电流。
将上述实验改进成如图2的装置,当观察到 ,此时锌层恰好反应。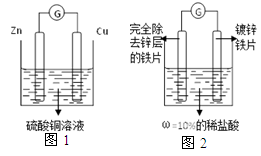
【实验步骤】(3)48.1mL (4)气泡产生的速率突然减慢
【计算结果】(1)0.02g (2)0.37mm
【实验反思】偏长
【实验改进】电流计指针指向“0”
解析试题分析:【实验步骤】(3)这是一个溶液配制的稀释问题,抓住稀释过程中溶质的质量不变列等式,可设需要浓盐酸的体积为V,则200ml×1.05g/ml×10%=V×1.18g/ml×37%,解得V=48.1ml
(4)根据锌的活动性比铁强,与盐酸反应时,锌的反应速率更快,所以将镀锌铁片放入溶质质量分数为10%盐酸中。当观察到:气泡产生的速率突然减慢,可以判断镀锌层恰好反应
【计算结果】(1)反应开始前用电子天平称量质量0.857g,反应结束后将溶液中的铁片取出清洗、擦干、烘干后用电子天平称量质量0.837g,所以铁片镀锌层的质量=0.857g-0.837g=0.02g
(2)根据密度的公式:V="0.02g/7.1g/" cm3="0.0028" cm3,再根据体积的计算公式:计算出铁片镀锌层厚度0.37mm
【实验反思】实际计算结果偏大,同学们分析,这是因为很难通过观察现象判断镀锌层恰好反应,造成镀锌铁片浸泡在盐酸中时间偏长
【实验改进】根据两种金属活动性不同的金属放入酸碱盐溶液中,会有电子的流动,从而产生电流所以将上述实验改进成如图2的装置,当观察到:电流计指针指向“0”,此时锌层恰好反应
考点:金属的活动性,实验的设计

 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案(7分)我省赣州稀土资源丰富,稀土开采工序中使用的草酸、硫酸铵等产生的大量废水严重污染农业用水和生活用水。某研究性学习小组对此展开了研究。
[查阅资料]
(一)草酸的化学式为H2C2O4,草酸是一种无色透明的晶体,对人体有害,具有酸的通性:如能与碳酸盐反应产生二氧化碳,能与金属反应等。
例如:H2C2O4+Na2CO3==Na2C2O4+CO2↑+H2O
(二)CO遇到浸有磷钼酸溶液的氯化钯黄色试纸立即变蓝,而CO2遇试纸不变色。
回答下列问题:
(1)写出金属铁与草酸反应的化学方程式
(2)硫酸铵在农业上可作化肥使用,在施肥时不能将它与 混合使用。
[设计方案]草酸加热能分解生成水和气体,研究性学习小组的同学对受热分解生成的气体作如图所示的探究: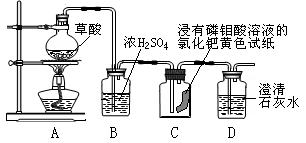
[实验探究]该研究性学习小组同学通过观察实验中的现象,验证猜想。
[现象与结论]请你帮助他们完成报告:
| 步骤 | 现象 | 结论 |
| 点燃酒精灯加热,观察装置C和D中的现象 | 装置C中 装置D中 | 产生的气体有CO 产生的气体有CO2 |
(2)根据结论,从环保的角度考虑,装置中存在不足之处,正确的处理方法是
科学探究是奇妙的过程,请你一起参与并填写下列空白。
【提出问题】小森同学在滴加FeCl3溶液时,不小心把滴加FeCl3溶液的滴管放入到盛“双
氧水”(过氧化氢)的试剂瓶中,发现有大量的气泡产生。小森联想到用二氧化锰可作为过氧化氢的催化剂,他想FeCl3溶液能否也可以作为过氧化氢分解的催化剂呢?于是他做了以下探究。
【猜想与假设】FeCl3溶液能作过氧化氢分解的催化剂
【设计与实验】
| 实验步骤 | 实验现象 | 实验结论 |
| 在一支试管中加入5mL15%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管 | | FeCl3溶液可以催化分解H2O2 |
已知FeCl3溶液中含有H2O 、Fe3+和Cl-三种微粒,小森同学又做了三种猜想:
猜想1:真正催化分解H2O2的是FeCl3溶液中的H2O
猜想2:真正催化分解H2O2的是FeCl3溶液中的Fe3+
猜想3:真正催化分解H2O2的是FeCl3溶液中的CI—
你认为最不可能的是哪一种猜想, 。小森同学认为,要验证猜想,至少还需要做 个对比实验。
(11分)实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样。已知它是无色液体,是初中化学常用的试剂。小强和小华同学很感兴趣,决定对其成分进行探究:
【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是 。
A.酸 B.碱 C.盐
【查阅资料】
Ⅰ.初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
Ⅱ. Na2CO3和NaHCO3溶液都呈碱性。
Ⅲ.测定室温(20℃)时,四种物质的溶解度的数据如下:
| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度/g | 36 | 109 | 215 | 9.6 |
这瓶试剂不可能是 。
【作出猜想】①可能是 溶液;②可能是Na2CO3溶液;③可能是NaCl。
【设计并实验】
(1)小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,这瓶试剂不可能是。
(2)小强为了检验该溶液是NaOH溶液还是Na2CO3溶液,他又进行了如下实验:
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中, 滴加氢氧化钙溶液 | | 猜想②正确 相关的化学方程式 |
小华同学用上述溶液对实验室制取CO2气体的废液进行后续探究,他向100克的废液中逐滴加入上述Na2CO3溶液。实验过程中加入Na2CO3溶液质量与产生沉淀或气体的质量关系如图1所示;加入Na2CO3溶液的质量与溶液的PH变化关系如图2所示
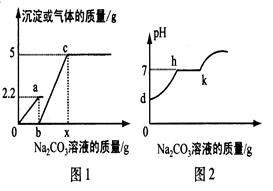
(3)小华同学所取废液中的溶质含
(4)图1中b→c段反应过程中溶液的PH变化情况可用图2中 段表示
(5)图1中b和x的值分别为 克和 克
Ⅰ(6分)某化学兴趣小组对CO2是否支持常见金属的燃烧进行探究活动。
【活动】探究CO2是否支持实验室常见金属镁的燃烧
实验①:将燃着的镁条插入充满CO2的集气瓶,发现镁条仍燃烧。生成物除白色MgO外,还有一种黑色固体。
(1)镁在CO2中反应的化学方程式为 ;
(2)实验①的结论是 ,由该结论可知 (写“能”或“不能”)用CO2灭火器扑灭活泼金属的火灾。
(3)通过实验①你对燃烧条件的新认识是 。
Ⅱ(15分)小丽在探究碱的化学性质时,将稀盐酸滴入到氢氧化钠溶液中,意外地看到有气泡产生,她认为氢氧化钠溶液已经变质了。用化学方程式表示氢氧化钠溶液变质的原因: 。
【提出问题】变质后的氢氧化钠溶液中的溶质是什么?
【猜想假设】小丽对变质后的氢氧化钠溶液中的溶质成分做出了两种猜想:
猜想一: ;猜想二: ;
【实验设计】为验证上述猜想哪个正确,小丽设计了如下方案:取少量氢氧化钠溶液样品于试管中,滴加几滴无色酚酞溶液,观察溶液颜色变化。
小红认为小丽的实验方案不合理,理由是: 。
【实验与结论】小红另外设计并完成了实验,请你帮她填写下面的实验报告:
| 实验步骤 | 实验现象 | 结论 |
| 步骤1:取少量氢氧化钠溶液样品于试管中,向其中滴加过量的 | | 猜想一 正确 |
| 步骤2:将步骤1试管中的混合物过滤,向滤液中滴加无色酚酞溶液 | |
7分)某同学将光亮的镁条放入NaHCO3饱和溶液中,镁条消失并产生大量气泡和白色固体。 为确定产生的气体和白色固体的成分,该同学进行了如下的探究。
(1)收集并点燃产生的气体,火焰呈淡蓝色,火焰上方罩涂有澄清石灰水的小烧杯,无现象,则该气体为 。
(2)对白色固体做出如下猜测并进行实验:
【猜想假设】①白色固体可能是Mg(OH)2;
②白色固体可能是MgCO3;
③白色固体可能是 。
【查阅资料】①:Mg(HCO3)2能溶于水; ②:MgCO3、Mg(OH)2加热易分解,分别生成两种氧化物。
③:碱石灰主要成分是NaOH和CaO的混合物。
【进行实验】
| 操作 | 现象 | 结论 |
| 取洗净后的白色固体,加入足量的 | 观察到 | 白色固体一定含有MgCO3 |
| 秤取一定量白色固体,充分加热至不再产生气体,将产生的气体先通入碱石灰,再通入浓硫酸,分别称量装置反应前后的质量 | 碱石灰增重,浓硫酸不变 | |
“五一”假期,小兵对“锌与硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a.可能与硫酸的质量分数有关;b.可能与锌的形状有关。
【设计并实验】小兵用不同质量分数的硫酸和不同形状的锌进行如下实验。
| 实验编号 | 硫酸的质量分数(均取20mL) | 锌的形状(均取1g) | 氢气的体积(mL)(均收集3分钟) |
| | 20% | 锌粒 | 31.7 |
| | 20% | 锌片 | 50.9 |
| | 30% | 锌粒 | 61.7 |
| | 30% | 锌片 | 79.9 |
(1)写出稀硫酸与锌反应的化学方程式 。
(2)小兵用下图装置收集并测量氢气的体积,其中量筒的作用是 。
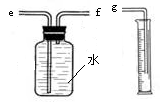
【收集证据】(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是 。
【得出结论】(4)结论是 。
【评价与反思】
(5)下表是小兵第①组实验的详细数据。
| 时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
请描述锌与硫酸反应的快慢的变化并解释原因 。
(6)锌与硫酸反应的快慢可能还受哪些因素影响? 。