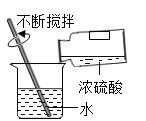
题目内容
【题目】将三种不同浓度的氢氧化钠溶液分别滴入对应浓度的盐酸中,反应的曲线如图所示。
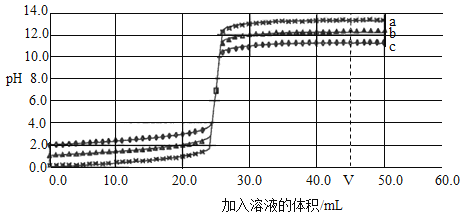
下列说法正确的是( )
A.在a、b、c三种曲线所示实验中,a曲线所用盐酸浓度最小
B.在a曲线所示的实验中,若用酚酞作指示剂,酚酞溶液由红色变为无色
C.当加入溶液体积为20mL时,溶液中存在的离子主要是Na+ Cl- H+ OH-
D.当溶液pH=7时,a、b、c曲线中分别加入的溶液体积相同
【答案】D
【解析】
A、在加入相同较少体积的氢氧化钠后,a中pH最小,说明酸的浓度较大,无法被氢氧化钠较快中和,所以a曲线所用盐酸浓度最大,选项A错误;
B、开始反应时,溶液pH小于7为酸性,酚酞不变色,当加入氢氧化钠溶液体积超过25mL以后,才开始显碱性,酚酞使溶液变红色,所以是由无色变为红色,选项B错误;
C、当加入20mL溶液时,三者的pH都小于7,说明酸过量,不会存在碱,所以没有氢氧根离子的存在,选项C错误;
D、当pH=7时,三者相交于一点,此时加入溶液体积相同,选项D正确。故选D。

练习册系列答案
相关题目