题目内容
【题目】下列是自来水厂净化水的流程图。

(1)试剂A为______。
(2)高铁酸钾(K2FeO4)常用作絮凝剂和消毒剂,高铁酸钾中铁元素的化合价为__________。
(3)二氧化氯(ClO2)是新一代自来水消毒剂。它属于________(填字母序号)。
A.化合物 B.氧化物 C.混合物
【答案】活性炭 +6 AB
【解析】
(1)根据活性炭具有吸附性解答;
(2)根据在化合物中正负化合价代数和为零,高铁酸钾的化学式进行解答即可;
(3)根据物质的分类进行解答。
(1)活性炭具有吸附性,可以吸附色素和杂质,试剂A为活性炭;
(2)因为钾元素显+1价,氧元素显-2价,设:铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(-2)×4=0,则x=+6;
(3)根据二氧化氯(ClO2)化学式可知,二氧化氯是由两种元素组成,其中一种是氧元素的化合物,它属于氧化物,故选AB。

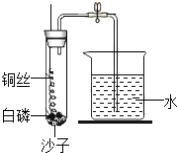
【题目】探究一:按照体积计算空气中氧气约占_________%,一号化学兴趣小组的同学按照课本的实验装置做“测定空气中氧气的体积分数”实验,但测出的氧气体积分数明显偏小,设计改进实验(图1)
(查阅资料)
颜色、状态 | 熔点/℃ | 燃烧所需最低温度/℃ | 密度/gcm﹣3 | |
红磷 | 暗红色固体 | 590 | 240 | 2.34 |
白磷 | 白色固体 | 44.1 | 40 | 1.82 |
(1)写出课本实验集气瓶中红磷发生反应的文字表达式____________,属于_____反应。
(2)课本实验测出氧气体积分数偏小的原因中:_____________,__________。
(3)对课本实验装置进行了如图1的改进.
①把红磷更换为白磷,理由是______________________________;
②通过粗铜丝来点燃玻璃管内的白磷,利用了金属铜的_____性;
③与课本实验装置相比,图1装置的一个优点是_________________。
探究二:二号化学兴趣小组设计了图2所示的装置,探究空气中氧气的体积分数,其中A是底面积为50cm2、高20 cm的圆筒状玻璃容器(带密封盖),上面标有以cm为单位的刻度,B是带刻度的敞口玻璃管(其他辅助装置略)。他们的操作过程如下:
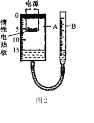
a.检查装置气密性;b.加水并调整B的高度,使A中的液面至刻度15 cm处;
c.将过量的铜粉平铺在惰性电热板上,盖紧密封盖。(提示:铜和氧气在加热的条件下反应生成氧化铜)
d.通电加热铜粉,待充分反应后,冷却到原来的状况,调整B的高度使容器A、B中的液面保持水平,记录液面刻度。(注:A容器内固态物质所占的体积忽略不计)
(1)在操作a中检查装置气密性的方法:往B中加水,使A、B液面保持水平,盖紧A的密封盖,再用手捂住A的外壁,若B中的液面上升,则气密性___(填“好”或“不好”)
(2)在上述实验中,下列物质不能代替铜粉的是________(填字母)。
A.红磷 B.木炭 C.硫
(3)在操作d结束时,装置A中液面的刻度约为________cm(填整数)。如果在操作d结束时,装置A中液面刻度在11cm处,则实验结果比理论值________(填“偏大”或“偏小”)。
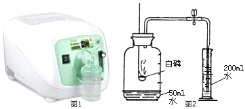
【题目】右图为家用制氧机内部铝分子筛吸收塔结构图中。家用制氧机工作原理:加压时,分子筛吸附 空气中的氮气,减压时,分子筛将所吸附的氮气排放。以下是关于空气制氧机的认识:
(1)对于空气的认识
a.已知:常压下,氮气沸点为-196℃,氧气沸点-183℃,将燃着的木条置于盛满液态空气的烧杯口,观察到的现象是____。
b.下列保护空气措施合理的是_________。
A.工厂加高烟囱直接排放废气 B.大力植树造林 C.提倡步行、骑自行车等低碳出行方式
(2)对家用制氧气机的认识
a.小丽用家用制氧机制取并收集了 200mL 气体,测定其中氧气含量.(装置如图 2,集气瓶体 积 250mL)
1 | 2 | 3 | 4 | 5 | ||||
量筒中剩余水体积/mL | 100 | 42 | 39 | 41 | 38 |
[数据处理]上表数据中,第 1 组数据偏差较大,存在明显误差,在数据处理时应删除。小丽所制气体中氧气的体积分数为_____
(实验反思)导致第 1 组数据产生较大误差的可能原因是_____(写一种即可)
b.制氧机分子筛吸附氮气以后,剩余气体:
从分类角度:剩余气体属于______(填“纯净物”或“混合物”)
从微观角度:用“![]() ”表示氮原子,“
”表示氮原子,“![]() ”表示氧原子。则用“
”表示氧原子。则用“![]() ”可表示的微粒是_____(填名称).
”可表示的微粒是_____(填名称).
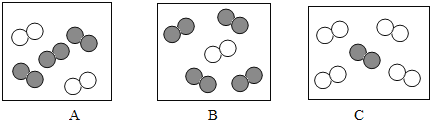
同温同压下,气体的体积比等于分子数目比。若空气中其它成分忽略不计。图中可表示空气微 观模型的是_____(填字母标号)。
【题目】加热条件下.在一个密闭的容器内有如下反应,反应过程中两次测得各物质的质量如表所示:
物质 | P | Q | R | W | ||||
第一次测得的质量/g | 40 | 4 | 3.6 | 4.8 | ||||
第二次测得的质量/g | 待测 | 13 | 12.6 | 10.8 | ||||
| A. | 上述化学反应方程式一定为P | ||||||
| B. | 该反应R与W的质量变化之比为2:3 | ||||||
| C. | 两次测定之间生成W的质量为10.8g | ||||||
| D. | 第二次测得P的质量为16g | ||||||