题目内容
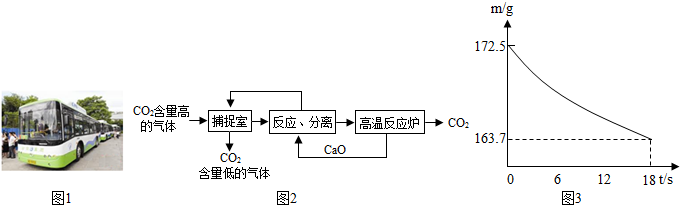
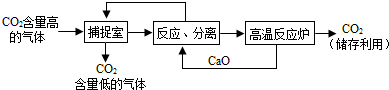
“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存和利用.实际生产中,常利用NaOH溶液来“捕捉”CO2,过程如图所示(部分条件及物质未标出).

(1)捕捉室内反应的化学方程式为______.
(2)“反应分离”中反应的化学方程式为______;______.
分离所采用的操作方法是______.
(3)该生产过程中,没有涉及的基本反应类型的是______.
(4)下列有关该捕捉过程的叙述正确的有______.
A.捕捉到的CO2可制备其它化工产品,减少了温室气体排放
B.“反应分离”中的反应要吸收大量热
C.整个过程中,只有一种物质可循环利用
D.能耗大是该捕捉技术的一大缺点.
解:(1)捕捉室中发生反应的化学反应是二氧化碳和氢氧化钠溶液反应生成碳酸钠和水,其化学方程式为CO2+2NaOH=Na2CO3+H2O.
故答案是:CO2+2NaOH=Na2CO3+H2O;
(2)CaO和水反应生成氢氧化钙,其反应方程式为:CaO+H2O=Ca(OH)2;然后氢氧化钙与碳酸钠反应生成白色沉淀碳酸钙和氢氧化钠,其反应方程式为:
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;固体与液体分开用过滤;
故答案是:CaO+H2O=Ca(OH)2;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;过滤;
(3)反应CaO+H2O=Ca(OH)2属于化合反应;
反应Na2CO3+Ca(OH)2=CaCO3↓+2NaOH属于复分解反应;
在高温反应炉内是高温下分解碳酸钙,属于分解反应.
综上所述,该生产过程中没有涉及到的反应是置换反应.
故答案是:置换反应;
(4)A、因为二氧化碳是造成温室效应的主要气体之一,捕捉到的CO2可制备其它化工产品,从而减少了温室气体排放,故A正确;
B、氧化钙与水反应放出大量的热,属于放热反应.故B错误;
C、在反应中,二氧化碳和氢氧化钠都可以循环利用,故C错误;
D、通过以上一系列的反应可以看出该捕捉技术的一大缺点是反应复杂且能耗大;
故选AD.
分析:(1)根据二氧化碳与氢氧化钠反应的反应物、生成物写出化学方程式;
(2)“反应分离”中发生的反应有:氧化钙溶于水生成氢氧化钙,然后氢氧化钙与碳酸钠反应生成白色沉淀碳酸钙和氢氧化钠,所以通过过滤可以将其分离开来;
(3)四种反应类型各有特点:化合反应多变一,分解反应一变多,置换反应单换单,复分解反应:化合价不变,成分两交换;
(4)根据题中信息进行判断.
点评:本题考查了物质的分类、俗称、化学方程式的书写和流程图的分析,注重对学生解读解能力的考查,有利于培养学生的探究能力.
故答案是:CO2+2NaOH=Na2CO3+H2O;
(2)CaO和水反应生成氢氧化钙,其反应方程式为:CaO+H2O=Ca(OH)2;然后氢氧化钙与碳酸钠反应生成白色沉淀碳酸钙和氢氧化钠,其反应方程式为:
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;固体与液体分开用过滤;
故答案是:CaO+H2O=Ca(OH)2;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;过滤;
(3)反应CaO+H2O=Ca(OH)2属于化合反应;
反应Na2CO3+Ca(OH)2=CaCO3↓+2NaOH属于复分解反应;
在高温反应炉内是高温下分解碳酸钙,属于分解反应.
综上所述,该生产过程中没有涉及到的反应是置换反应.
故答案是:置换反应;
(4)A、因为二氧化碳是造成温室效应的主要气体之一,捕捉到的CO2可制备其它化工产品,从而减少了温室气体排放,故A正确;
B、氧化钙与水反应放出大量的热,属于放热反应.故B错误;
C、在反应中,二氧化碳和氢氧化钠都可以循环利用,故C错误;
D、通过以上一系列的反应可以看出该捕捉技术的一大缺点是反应复杂且能耗大;
故选AD.
分析:(1)根据二氧化碳与氢氧化钠反应的反应物、生成物写出化学方程式;
(2)“反应分离”中发生的反应有:氧化钙溶于水生成氢氧化钙,然后氢氧化钙与碳酸钠反应生成白色沉淀碳酸钙和氢氧化钠,所以通过过滤可以将其分离开来;
(3)四种反应类型各有特点:化合反应多变一,分解反应一变多,置换反应单换单,复分解反应:化合价不变,成分两交换;
(4)根据题中信息进行判断.
点评:本题考查了物质的分类、俗称、化学方程式的书写和流程图的分析,注重对学生解读解能力的考查,有利于培养学生的探究能力.

练习册系列答案
相关题目