题目内容
【题目】鸡蛋壳的主要成分是碳酸钙,为了测定蛋壳中碳酸钙的质量分数,小刚和小勇同学进行了如下实验。实验过程和测定的相关实验数据如下所示:请回答相关问题:

(1)逸航同学根据“蛋壳残渣质量为4.3g”,求得蛋壳中碳酸钙的质量分数为 ;
(2)鑫烁同学根据“反应过程中减少的质量”,也求得了蛋壳中碳酸钙的质量分数,请你写出鑫烁的计算过程和结果。
(3)逸航和鑫烁根据不同的数据求得蛋壳中碳酸钙的质量分数有明显差别,请你分析其中可能的原因 。
【答案】(1)57℅(2分)(2)75℅(6分)(3)蛋壳残渣没有烘干或盐酸较浓生成的二氧化碳中混有氯化氢、水蒸气等合理即可。
【解析】
试题分析:(1)因碳酸钙与酸反应,则残渣质量为4.3g,碳酸钙的质量为10g-4.3g=5.7g,则蛋壳中碳酸钙的质量分数为![]() ×100%=57%,故答案为:57%;
×100%=57%,故答案为:57%;
(2)而鑫烁的计算过程如下:设碳酸钙的质量为x,根据质量守恒可知CO2的质量10g+100g-106.7g=3.3g,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 3.3g
![]() ,解得x=7.5g, 则碳酸钙的质量分数为
,解得x=7.5g, 则碳酸钙的质量分数为![]() ×100%=75%,
×100%=75%,
答:蛋壳中碳酸钙的质量分数为75%,
(3)逸航计算所用的蛋壳残渣可能未干燥,实际蛋壳残渣质量小于4.3g
或鑫烁计算所用的数据“3.3g”中包含了反应过程中盐酸挥发了的氯化氢气体的质量,
即实际生成的二氧化碳气体质量小于3.3g,
答:逸航和鑫烁根据不同的数据求得蛋壳中碳酸钙的质量分数有明显差别的原因可能为残渣质量未干燥就称量或气体不纯而造成的.

【题目】化学兴趣小组同学对“铁生锈的条件”进行实验探究。
【进行实验】
实验 | 实验操作 | 实验现象 | 实验结论 |
1 |
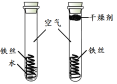
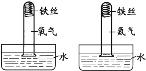
A B | 一段时间后, A中铁丝表面有红色固体生成 B中铁丝无明显变化 | |
2 |
C D | 一段时间后, C中 D中铁丝无明显变化 | 铁生锈需要与O2接触 |
某同学在家中发现,炒完菜的铁锅表面容易生锈。
【猜想与假设】可能是食盐对铁生锈的速率产生了影响。
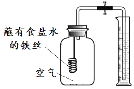
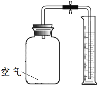
【进行实验】该小组用实验装置E、F同时进行实验。其中集气瓶的容积相同,量筒内盛有等体积的水,F中集气瓶内另加入了某种物质。
实验装置 | 实验过程 | 实验结论 |
E F | 一段时间后,打开止水夹,记录实验过程中量筒内剩余水的体积(每次测量时间间隔不等,实验数据见下表)。E中铁丝和F中另加入的物质表面均出现红色物质。 | 食盐可以加速铁的生锈 |
实验记录表
次数 | 1 | 2 | 3 | 4 | 5 | 6 | |
量筒中剩余水的体积/mL | E | 68 | 57 | 44 | 30 | 30 | 30 |
F | 71 | 65 | 56 | a | 30 | 30 | |
(1)实验装置F中,集气瓶内另加入的物质是 。
(2)实验记录表中,a的取值范围是 。
【反思与应用】结合上述实验,谈谈你对家中铁锅使用的建议: 。