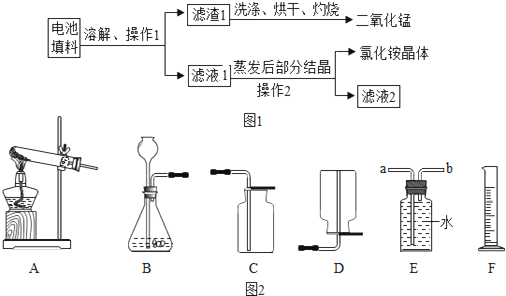
题目内容
探究小组用如图装置进行实验.胶头滴管和集气瓶中分别盛装某种试剂,挤压胶头滴管向集气瓶中滴加适量液体后,能观察到气球变大的组合是( )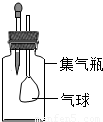
A.胶头滴管中的试剂:稀硫酸;集气瓶中的试剂:Na2CO3
B.胶头滴管中的试剂:稀盐酸;集气瓶中的试剂:Zn
C.胶头滴管中的试剂:NaOH溶液;集气瓶中的试剂:CO2
D.胶头滴管中的试剂:浓硫酸;集气瓶中的试剂:水
【答案】分析:观察到集气瓶中气球变大,说明集气瓶内气体减少而使压强减小,与大气相通的气球变大,因此,集气瓶内应发生气体被吸收的反应;根据每组物质的性质及变化规律,做出判断.
解答:解:A、向碳酸钠中滴加稀硫酸,硫酸与碳酸钠反应放出气体二氧化碳,放出气体使瓶内气体增多,气球不能变大;故A不正确;
B、向锌中滴加稀盐酸,盐酸与锌反应放出氢气,放出气体使瓶内气体增多,气球不能变大;故B不正确;
C、向气体二氧化碳中滴加氢氧化钠溶液,氢氧化钠吸收二氧化碳变成碳酸钠和水,瓶内气体减少甚至消失,气球变大;故C正确;
D、向水中滴入浓硫酸,浓硫酸溶于水放出大量的热,放出的热使瓶内空气膨胀而使瓶内压强变大,气球不能变大;故D不正确;
故选C.
点评:本题主要涉及硫酸、盐酸和氢氧化钠三种物质的性质,正确掌握常见物质的性质,熟练地运用性质解决问题.
解答:解:A、向碳酸钠中滴加稀硫酸,硫酸与碳酸钠反应放出气体二氧化碳,放出气体使瓶内气体增多,气球不能变大;故A不正确;
B、向锌中滴加稀盐酸,盐酸与锌反应放出氢气,放出气体使瓶内气体增多,气球不能变大;故B不正确;
C、向气体二氧化碳中滴加氢氧化钠溶液,氢氧化钠吸收二氧化碳变成碳酸钠和水,瓶内气体减少甚至消失,气球变大;故C正确;
D、向水中滴入浓硫酸,浓硫酸溶于水放出大量的热,放出的热使瓶内空气膨胀而使瓶内压强变大,气球不能变大;故D不正确;
故选C.
点评:本题主要涉及硫酸、盐酸和氢氧化钠三种物质的性质,正确掌握常见物质的性质,熟练地运用性质解决问题.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
 (2013?贵阳模拟)某班级兴趣小组计划对金属与酸反应的情况进实验探究.
(2013?贵阳模拟)某班级兴趣小组计划对金属与酸反应的情况进实验探究. 人类的生存离不开氧气.某校化学兴趣小组的同学在老师的指导下做了有关氧气的系列探究实验:
人类的生存离不开氧气.某校化学兴趣小组的同学在老师的指导下做了有关氧气的系列探究实验: