题目内容
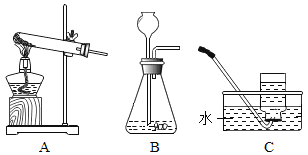
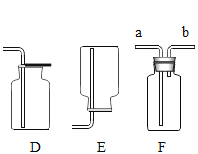
【题目】某化学研究性学习小组的同学们做了三个趣味实验,装置如图(气密性良好)。当开启分液漏斗的旋塞,液体滴入盛有固体的试管2中时,观察到不同的现象。
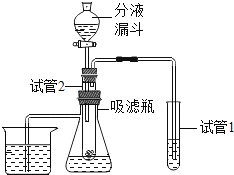
(1)若试管2中发生了化学反应,观察到试管1中有气泡产生,且其中的石蕊溶液变红,试管2中发生反应的化学方程式为_____。
(2)若试管2中没有发生化学反应,观察到两支导管口同时冒气泡、吸滤瓶内的澄清石灰水变浑浊,则试管2中的固体可能是_____。
(3)若观察到吸滤瓶内盛有的滴有酚酞的氢氧化钠红色溶液变无色,分液漏斗中的液体、试管2中的固体分别可能是_____;烧杯中的液体可能是_____。请你解释溶液由红色变无色的原因:_____。
【答案】CaCO3+2HCl═CaCl2+H2O+CO2↑ 氢氧化钠 硝酸铵 酸(如盐酸) 硝酸铵溶于水时吸收热量,使吸滤瓶中气体温度降低,压强减小,烧杯中的酸溶液倒吸入锥形瓶中,与锥形瓶中碱性物质发生反应,使红色溶液变无色。
【解析】
(1)生成能使石蕊溶液变红的气体说明是一种酸性气体;碳酸钙和盐酸反应生成二氧化碳符合此反应现象,故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)氢氧化钙的溶解度随温度升高减小,若试管2中没有发生化学反应,观察到两支导管口同时冒气泡、吸滤瓶内的澄清石灰水变浑浊,说明试管2内温度升高,则试管2中的固体可能是氢氧化钠;
(3)试管2中的固体分别是水、硝酸铵;烧杯中的液体可能是酸的溶液(如盐酸);溶液变色的原因:硝酸铵溶于水时吸收热量,使吸滤瓶中气体温度降低,压强减小,烧杯中的酸溶液倒吸入锥形瓶中,与锥形瓶中碱性物质发生反应,使红色溶液变无色。

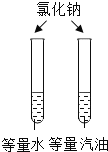
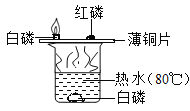
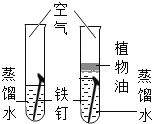
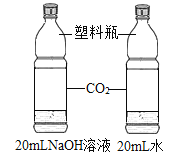
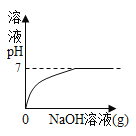
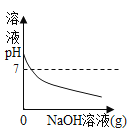
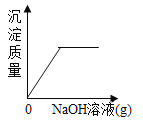
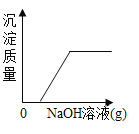
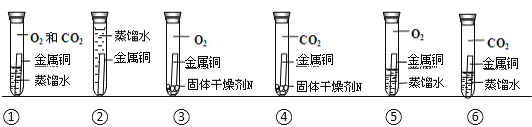
【题目】设计对比实验,控制变量是学习化学的重要方法,下列对比实验不能达到目的的是
编号 | ① | ② | ③ | ④ |
实验设计 |
|
|
|
|
实验目的 | 探究同种物质在不同溶剂中的溶解性 | 探究可燃物燃烧的条件 | 探究铁生锈的条件 | 探究CO2与NaOH溶液能否发生反应 |
A.AB.BC.CD.D
【题目】下表是氯化铵固体在不同温度下的溶解度
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 | 65.6 |
①向100 g水中不断加入氯化铵固体或改变温度,得到下图相应的溶液A~E。
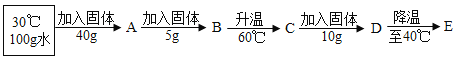
溶液D是_____ (填“ 饱和”或“不饱和”)溶液,溶液E中析出晶体__g。
②将盛有溶液E的小烧杯放入盛有水的大烧杯中,向大烧杯内加入NaOH固体,小烧杯内的固体溶解,原因是______。