题目内容
【题目】实验室加热KClO3与MnO2的混合物 33.2g 制取氧气,完全反应后剩余固体质量为 23.6g。已知反应的化学方程式为:2KClO3 ![]() 2KCl+3O2↑。
2KCl+3O2↑。
(1) 计算MnO2中锰元素和氧元素质量比等于_________;
(2) 计算生成O2的质量为_________ g;
(3) 计算原混合物中氯酸钾的质量 _________g;(写出解题过程)
(4) 计算原混合物中氧元素质量分数约为__________。(保留一位小数)
【答案】55:32 9.6 24.5 38.6﹪
【解析】
(1)MnO2中锰元素和氧元素质量比等于55:(16×2)=55:32;
(2)根据题意,反应前混合物的质量为33.2g 制取氧气,完全反应后剩余固体质量为 23.6g,故生成氧气的质量为:33.2g-23.6g=9.6g;
(3)设混合物中氯酸钾的质量为x,根据方程式2KClO3 ![]() 2KCl+3O2↑可列出关系式
2KCl+3O2↑可列出关系式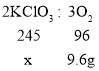
![]() x=24.5g
x=24.5g
(4)原混合物的质量为33.2g,氯酸钾的质量为24.5g,二氧化锰的质量为:33.2g-24.5g=8.7g,二氧化锰中氧元素的质量为:![]() ,
,
原混合物中氧元素的质量等于二氧化锰中氧元素的质量和氯酸钾中氧元素的质量,根据质量守恒定律,氯酸钾中氧元素的质量等于反应产生的氧气质量,原混合物中氧元素的质量等于3.2g+9.6g=12.8g,质量分数等于:![]() 。
。

练习册系列答案
相关题目