题目内容
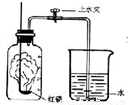
我们已经知道空气的主要成分是氮气和氧气,如图所示为测定空气中氧气含量的实验示意图.
(1)实验时,燃烧匙里为什么要盛过量的红磷?________.
(2)这个实验除了可以得出氧气约占空气体积的![]() 的结论外,还可以得出有关氮气物质的哪些结论?________.
的结论外,还可以得出有关氮气物质的哪些结论?________.
(3)如何证明生成的白色固体溶于水后的溶液显酸性?________.
答案:
解析:
解析:
|
答案:(1)红磷过量才能将空气中的氧气消耗完全,测出的氧气体积才更接近空气中氧气的实际体积 (2)难溶于水,化学性质不活泼 (3)将燃烧匙中的白色固体加入一支试管中,加水溶解,再滴加紫色石蕊试液,石蕊试液变为红色,证明生成的白色固体溶于水后的溶液显酸性 分析:本题中用燃烧红磷的方法除去一定体积的空气中的氧气,再通过水面升高的情况来判定空气中氧气的体积分数.这就要求:①红磷必须过量,才能把一定体积的空气中的氧气完全消耗掉;②产物不能是气体,否则无法测定实验结果.因此,实验中使用红磷作燃烧物,且必须过量. 由此可推出:在点燃条件下,氮气跟红磷、氧气、五氧化二磷均不发生反应,氮气难溶于水.红磷燃烧产生大量白烟,生成五氧化二磷固体,当五氧化二磷沉降下来溶解于水时,发生下列化学反应:3H2O+P2O5 |

练习册系列答案
相关题目
 (2009?普陀区一模)我们已经知道空气的主要成分是氮气和氧气,如图为测定空气中氧气含量的实验示意图.
(2009?普陀区一模)我们已经知道空气的主要成分是氮气和氧气,如图为测定空气中氧气含量的实验示意图.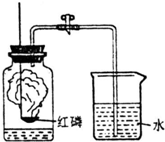 我们已经知道空气的主要成分为氮气和氧气,如图为测定空气中氧气含量的实验示意图.
我们已经知道空气的主要成分为氮气和氧气,如图为测定空气中氧气含量的实验示意图.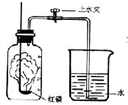 我们已经知道空气的主要成分是氮气和氧气,图为测定空气中氧气含量的实验装置示意图.
我们已经知道空气的主要成分是氮气和氧气,图为测定空气中氧气含量的实验装置示意图.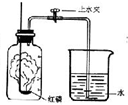 我们已经知道空气的主要成分是氮气和氧气,图为测定空气中氧气含量的实验装置示意图.
我们已经知道空气的主要成分是氮气和氧气,图为测定空气中氧气含量的实验装置示意图.