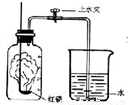
题目内容
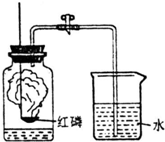 我们已经知道空气的主要成分为氮气和氧气,如图为测定空气中氧气含量的实验示意图.
我们已经知道空气的主要成分为氮气和氧气,如图为测定空气中氧气含量的实验示意图.(1)实验时,燃烧匙里为什么要盛放过量的红磷?完成发生反应的化学方程式.
(2)这个实验除了可以得出氧气约占空气体积
| 1 | 5 |
分析:(1)根据实验的原理是通过可燃物红磷来消耗装置内的氧气进行分析;
(2)根据实验的结果分析氮气的性质;
(2)根据实验的结果分析氮气的性质;
解答:解:(1)由于实验的原理是通过可燃物红磷来消耗装置内的氧气,通过最终液体的进入来测定氧气含量,所以要保证氧气的最大限度的消耗,这就需要加入相对过量的红磷;红磷燃烧生成五氧化二磷,反应的化学方程式为:4P+502
2P2O5 故答案为:红磷过量才能将空气中的氧气消耗完全,测出的氧气体积才更接近空气中氧气的实际体积;4P+502
2P2O5
(2)实验中当装置内进入水以后,氮气依然能够存在这就说明氮气是不溶于水的也不和水反应.另外在红磷和氧气反应的过程中,氮气没有被消耗,所以氮气不和氧气、红磷反应,故答案为:难溶于水,化学性质不活泼
| ||
| ||
(2)实验中当装置内进入水以后,氮气依然能够存在这就说明氮气是不溶于水的也不和水反应.另外在红磷和氧气反应的过程中,氮气没有被消耗,所以氮气不和氧气、红磷反应,故答案为:难溶于水,化学性质不活泼
点评:本题主要考查用红磷测定空气组成的实验原理、操作、现象、结论和注意事项,难度稍大.

练习册系列答案
相关题目
 (2009?普陀区一模)我们已经知道空气的主要成分是氮气和氧气,如图为测定空气中氧气含量的实验示意图.
(2009?普陀区一模)我们已经知道空气的主要成分是氮气和氧气,如图为测定空气中氧气含量的实验示意图.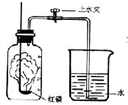 我们已经知道空气的主要成分是氮气和氧气,图为测定空气中氧气含量的实验装置示意图.
我们已经知道空气的主要成分是氮气和氧气,图为测定空气中氧气含量的实验装置示意图.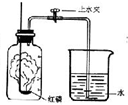 我们已经知道空气的主要成分是氮气和氧气,图为测定空气中氧气含量的实验装置示意图.
我们已经知道空气的主要成分是氮气和氧气,图为测定空气中氧气含量的实验装置示意图.