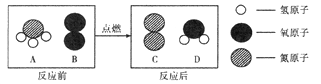
题目内容
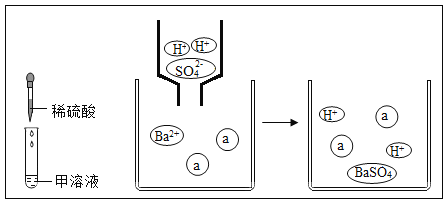
【题目】矿山废水中含有大量的H2SO4和CuSO4,直接排放会影响水体酸碱性,并造成重金属污染。通过处理可以回收金属铜,并使废水pH和重金属离子含量达到排放标准。
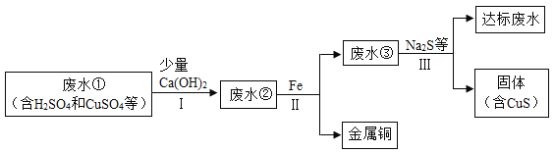
已知:步骤Ⅰ中Ca(OH)2与CuSO4并没有发生反应;CuSO4属于一种常见的重金属盐。
(1)步骤I发生反应的化学反应方程式为______。
(2)废水①中一定含有的阳离子有____。
(3)加入少量Ca(OH)2可以降低步骤Ⅱ中铁的消耗量,原因是____。
(4)步骤Ⅲ需加入Na2S才能使废水达到排放标准,由此推测废水③不达标的主要原因是其中还含有较多的____(填化学式或离子符号);达标废水pH比废水①pH ____(填“大”或“小”)。
【答案】Ca(OH)2+H2SO4 = CaSO4+2H2O H+和Cu2+ Ca(OH)2与H2SO4反应消耗了H2SO4,减少了H2SO4和Fe反应 CuSO4 或Cu2+ 大
【解析】
氢氧化钙和硫酸生成硫酸钙和水,铁和硫酸反应生成硫酸亚铁和氢气。
(1)步骤I加入少量的氢氧化钙,氢氧化钙和硫酸铜没有反应,发生反应是氢氧化钙和硫酸生成硫酸钙和水,反应的化学反应方程式为Ca(OH)2+H2SO4 = CaSO4+2H2O。
(2)废水①中含有硫酸和硫酸铜,硫酸中含有的阳离子是氢离子,硫酸铜中含有的阳离子是铜离子,故一定含有的阳离子有H+和Cu2+。
(3)铁能和硫酸反应生成硫酸亚铁和氢气,加入少量Ca(OH)2,氢氧化钙和硫酸反应生成硫酸钙和水,可以降低步骤Ⅱ中铁的消耗量,故原因是Ca(OH)2与H2SO4反应消耗了H2SO4,减少了H2SO4和Fe反应。
(4)步骤Ⅲ需加入Na2S才能使废水达到排放标准,能使废水达到排放标准,化学反应前后元素种类不变,生成物硫化铜中含有铜元素和硫元素,故废水③不达标的主要原因是其中还含有较多的硫酸铜或铜离子,化学式或离子符号为CuSO4 或Cu2+;硫酸显酸性,pH小于7,步骤Ⅰ加入少量的氢氧化钙,硫酸被消耗,达标废水pH比废水①pH大。

【题目】同学们在整理实验室时,发现一包白色粉末状药品,老师说该药品由氯化钠、碳酸钙、氢氧化钠中的两种组成,同学们对此很好奇,于是对这包白色粉末的成分进行如下探究。
(作出猜想)猜想一:_______ 猜想二:CaCO3和NaOH 猜想三:NaCl和NaOH
(设计实验)
实验步骤 | 实验现象 | 实验结论 |
(1)取一定量白色粉末于烧杯中,加足量水,搅拌 | ________ | 猜想三不成立 |
(2)取少量(1)中所得溶液于试管中,向其中滴入氯化铜溶液 | ________ | 猜想二不成立 |
(3)另取少量(1)中所得溶液于试管中,向其中滴加过量的____溶液 | 产生白色沉淀 | 猜想一成立 |
写出步骤(3)中发生反应的化学方程式____。
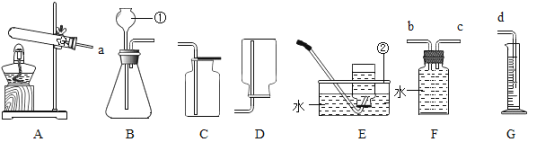
(拓展延伸)如何测定该白色粉末中碳酸钙的质量分数呢?某同学利用碳酸钙能与稀盐酸反应产生二氧化碳来测定该白色粉末中碳酸钙的质量分数,利用下列装置测定二氧化碳的质量。
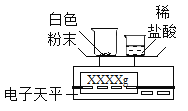
(1)将小烧杯中的所有稀盐酸分几次加入到大烧杯中并不断搅拌,判断白色粉末中碳酸钙完全反应的实验现象是_____。
(2)已知反应前的总质量[m(大烧杯+白色粉末)+m(小烧杯+稀盐酸)],要计算生成CO2的质量,至少还需要的数据是____(填序号)。
A m(小烧杯) B m(大烧杯) C m(大烧杯+反应后剩余物)
【题目】有限的元素可组成种类繁多的物质,依据表中的元素回答下列问题。
元素名称 | 氢 | 碳 | 氧 | 钙 | 铁 |
元素符号 | H | C | O | Ca | Fe |
(1)若某物质是相对分子质量最小的氧化物,该物质的化学式是_____。
(2)若某可燃性气体(天然气主要成分)在氧气中燃烧,能生成两种氧化物,该气体一定含有的元素是_____。
(3)若某元素组成的单质及其氧化物,均能和氧气发生化合反应生成同一种物质(该气体可以导致温室效应)。相关反应的化学方程式是______,______(分别写出单质,氧化物和氧气反应方程式)
(4)甲~己六种物质的转化关系如下图所示。已知甲能使澄清石灰水变浑浊;己是无色溶液,能在某种黑色固体物质催化下,生成可供给呼吸的气体丁。(部分反应物、产物及反应条件已略去,“ → ”表示物质之间能发生转化)
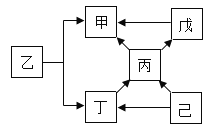
①己→丁反应的化学方程式是_______________。