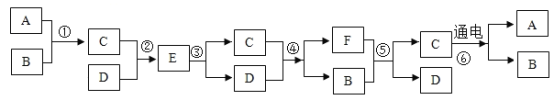
题目内容
【题目】5G时代的到来给中国芯片产业的发展带来了新的机遇。芯片制作的主要原料为晶体硅(Si)。硅元素在元素周期表中的信息和原子结构示意图如图所示。
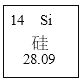

(1)硅元素属于_____(填“金属”或“非金属”)元素。
(2)其相对原子质量为_____。
(3)硅原子结构_____(填“属于”或“不属于”)稳定结构。
(4)晶体硅可以用SiO2制备,SiO2中硅元素的化合价为_____。
【答案】非金属 28.09(28) 不属于 +4
【解析】
通过元素单元格可知该元素的元素名称、符号和原子序数和相对原子质量。
(1)从元素名称上来看,硅为石字旁,故应该是一种非金属元素。
(2)元素单元格最下面的数字即为该元素的相对原子质量,即硅的相对原子质量为28.09。
(3)根据硅的原子结构示意图可知,硅最外层的电子数为4,当最外层电子数为8(He为2)时,达到稳定结构,故硅原子的结构不属于稳定结构。
(4)设硅元素的化合价为x。氧元素的化合价为-2价,根据化学式化合价代数和为0,可得:x+2×(-2)=0,x=+4。故Si的化合价为+4价。

 阅读快车系列答案
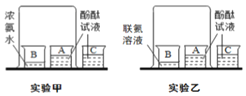
阅读快车系列答案【题目】(1)制取气体是初中化学实验的重要内容,请根据下列装置图回答问题:
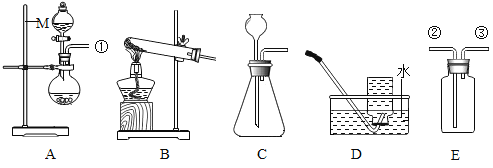
①仪器M的名称是_____;
②实验室用过氧化氢溶液与二氧化锰制备氧气,可选用的发生装置为_____(填字母序号),反应的符号表达式为_____;
③C装置中的一处明显错误为_____;
④某气体只能用D装置收集,则该气体可能具有的性质为_____(填字母序号);
a.能与水反应
b.能与空气反应
e.密度与空气接近
⑤若用A、E装置制取H2,按气体流向,导管口连接顺序为_____(填序号)。
(2)研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
①(假设)H2O2生成O2的快慢与催化剂种类有关
(实验方案)常温下,在两瓶同质量、同浓度的H2O2溶液中,分别加入相同质量的MnO2和水泥块,测量各生成一集气瓶(相同体积)O2所需的时间。
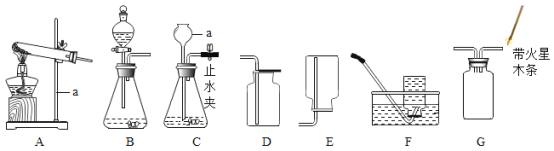
(进行实验)如图是他们进行实验的装置图,气体发生装置中A仪器名称是_____,此实验中B处宜采用的气体收集方法是_____。
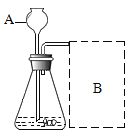
(实验记录)
实验编号 | 1 | 2 |
反应物 | 5% H2O2 | 5% H2O2 |
催化剂 | 1g水泥块 | 1gMnO2 |
时间 | 165秒 | 46秒 |
(结论)该探究过程得出的结论是_____。
②(假设)_____;
(实验方案)同温下取2份质量相等、质量分数不同的H2O2溶液,_____结果质量分数大的过氧化氢溶液生成的氧气快,先收集满集气瓶。
【题目】某化学兴趣小组对实验室制备氧气的条件进行如下探究实验。
(1)为探究催化剂的种类对氯酸钾分解速率的影响,甲设计以下对比实验:
Ⅰ.将3.0gKClO3与MnO2均匀混合加热
Ⅱ.将 xgKClO3与CuO均匀混合加热
在相同温度下,比较两组实验产生O2的快慢。
I中反应表达式是_____;Ⅱ中x的值应为______。
(2)乙探究了影响过氧化氢分解速率的某种因素。实验数据记录如下:
过氧化氢溶液的质量 | 过氧化氢溶液的浓度 | MnO2的质量 | 相同时间内产生O2体积 | |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
测量O2体积的装置是图甲中的________(填序号)。
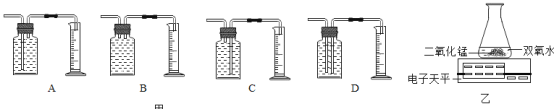
实验结论:在相同条件下,______,过氧化氢分解得越快。丙用图乙装置进行实验,通过比较_______也能达到实验目的。丁将盛有适量10%的过氧化氢溶液的试管加热,产生气泡明显增多。
实验结论:在相同条件下,_______,过氧化氢分解得越快。