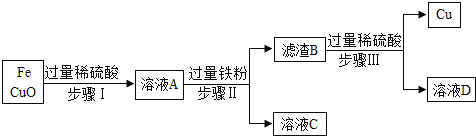
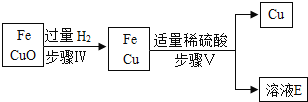
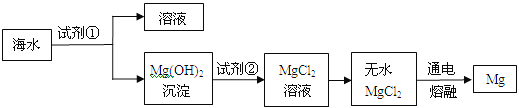
题目内容
【题目】科学家用锶原子研制的“晶格钟”,成为世界上最精准的钟。如图是锶元素在元素周期表中的信息及锶原子结构示意图,下列说法错误的是( )

A. Sr为金属元素
B. 乙图中X=2
C. 锶原子的相对原子质量为87.62g
D. 锶元素位于元素周期表的第五周期
【答案】C
【解析】
A、Sr是锶元素的元素符号,带“钅”字旁,属于金属元素,故选项说法正确。
B、当质子数=核外电子数,为原子,则38=2+8+18+8+x,x=2,故选项说法正确。
C、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为87.62,相对原子质量单位是“1”,不是“克”,故选项说法错误。
D、周期数=原子核外电子层数,锶元素的原子核外有5个电子层,则在元素周期表中,锶元素位于第五周期,故选项说法正确。
故选:C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目