题目内容
【题目】5分)镁是一种用途很广的金属,目前世界上60%的镁是从海水(主要含NaCl和MgCl2等)中提取的。主要步骤如下:
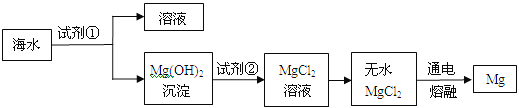
(1)上述步骤中试剂①应过量,理由是 。
(2)请写出Mg(OH)2沉淀与试剂②发生中和反应的化学方程式 。
(3)无水MgCl2在熔融状态下通电得到金属镁和物质A,氢气在物质A中燃烧生成物质B,则物质A和B的化学式分别为:A ,B 。
【答案】(1)使MgCl2完全转化为沉淀 (2)Mg(OH)2 + 2HCl = MgCl2 + 2H2O
(3)Cl2 HCl
【解析】
试题分析:(1)步骤中试剂①的目的是将MgCl2转化为沉淀,应加过量理由是:使MgCl2完全转化为沉淀 (2)中和反应是酸和碱作用生成盐和水,故Mg(OH)2沉淀与试剂②发生中和反应,说明所加试剂为稀盐酸,化学方程式:Mg(OH)2 + 2HCl = MgCl2 + 2H2O
(3)根据质量守恒定律,化学反应前后,元素的种类不变,故无水MgCl2在熔融状态下通电得到金属镁和物质A,,可推断物质A应为氯气,化学式为Cl2;氢气在氯气中燃烧生成物质氯化氢,化学式为: HCl

【题目】小华将一张滤纸在某示剂中浸泡后晾干,用蘸有氢氧化钠溶液的玻璃棒在上面写“化学”两字,立刻显红色。再将其悬挂于铁架台上,并在滤纸的下方(如图)放置一个盛有某溶液的烧杯,过一会儿,发现红色的字消失,则滤纸上的指示剂和烧杯中的溶液分别是( )
A | B | C | D | |
滤纸上的指示剂 | 酚酞溶液 | 酚酞溶液 | 石蕊溶液 | 石蕊溶液 |
烧杯中的溶液 | 浓氨水 | 浓盐酸 | 浓氨水 | 浓盐酸 |
A. A
B. B
C. C
D. D
【题目】在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有_____产生,反应的化学方程式是_____。
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀。
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因。
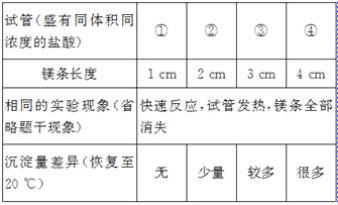
[得出结论]镁条与盐酸反应产生白色沉淀与_____有关。
[追问]白色沉淀是什么物质?
[查阅资料]①20 ℃时,100 g水中最多能溶解氯化镁54.8 g;
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸。
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是_____(用化学方程式表示)。
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
试管 | 操作 | 现象 | 结论 |
A | 加入足量盐酸 | _____,白色沉淀_____ | 猜想一不正确,但这种白色沉淀能溶于盐酸 |
B | 加入足量水 | 白色沉淀_____ | 猜想二不正确 |
C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是:Mg2+、_____ |
继续滴加几滴硝酸银溶液 | 出现大量白色沉淀 |