题目内容
【题目】实验室用下图装置制取纯净、干燥的CO2,并验证其部分性质。

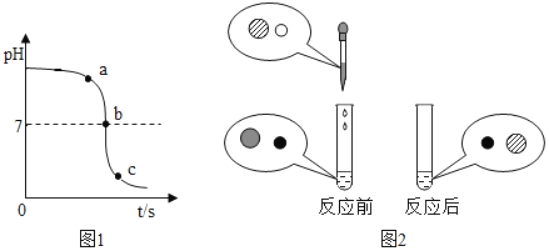
(1)装置A中发生反应的化学方程式为_____。
(2)装置B中液体变红色,请用化学方程式解释_____。
(3)为证明装置C中浓硫酸具有吸水性,烧杯D中应放入_____,观察到_____。
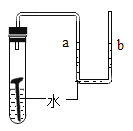
(4)下列装置不能证明CO2的密度比空气大的装置是_____。
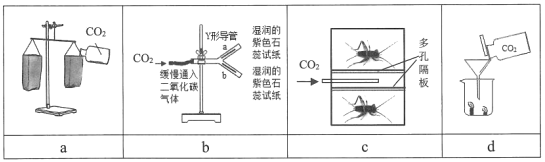
【答案】CaCO3+2HCl=CaCl2+H2O+CO2↑ CO2+H2O=H2CO3 无水硫酸铜 无水硫酸铜粉末无明显变化 d
【解析】
(1)实验室制取二氧化碳的反应是碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,故反应的化学方程式写为:CaCO3+2HCl=CaCl2+H2O+CO2↑。
(2)向紫色石蕊试液中通入二氧化碳后石蕊试液变红,是因为二氧化碳与水反应生成了碳酸,故反应的化学方程式写为:CO2+H2O=H2CO3。
(3)白色的无水硫酸铜遇水生成蓝色的硫酸铜晶体,所以可用无水硫酸铜检验气体中是否含有水分,故填无水硫酸铜;
将气体通入到装置D中,观察到无水硫酸铜粉末无明显变化,说明气体中不含水分,证明浓硫酸利用其吸水性将气体进行了干燥,故填无水硫酸铜粉末无明显变化。
(4)a 观察到盛有二氧化碳的纸袋向下倾斜,说明CO2的密度比空气大,选项正确;
b 实验中看到b中的湿润的紫色石蕊试液先变红,a中的湿润的紫色石蕊试液后变红,说明CO2的密度比空气大,选项正确;
c 实验中看到下方的小虫先窒息死亡,说明CO2的密度比空气大,选项正确;
d 实验中观察到高层蜡烛先熄灭,低层蜡烛后熄灭,不能说明CO2的密度比空气大,选项错误,故填d。

 阅读快车系列答案
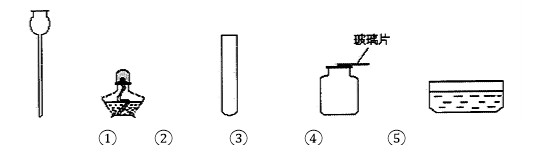
阅读快车系列答案【题目】下列是某化学小组探究物质组成与性质的实验装置图,根据要求回答:
A | B | C | D |
测定空气中氧气的含量 | 稀释浓硫酸 | 铁钉子空气中的变化 | 一氧化碳还原氧化铁 |
|
|
|
|
上述实验设计中有错误的是_____(填字母序号),A中可燃物应取过量的原因是_____。
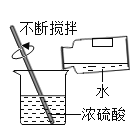
(1)B中玻璃棒搅拌的目的是_____,C中会出现的实验现象为_____。
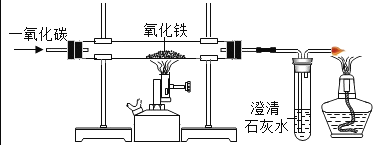
(2)D中硬质玻璃管内发生反应的化学方程式为_____,酒精灯的作用是_____。