题目内容
【题目】纯铁及其合金在人们的生产、生活中发挥着非常重要的作用。
(1)地铁的主要材料是钢铁。钢和纯铁相比,它具有的优越性能主要有_____(答出一条即可)。生铁在潮湿的环境中容易生绣,写出一条防锈的措施_____。
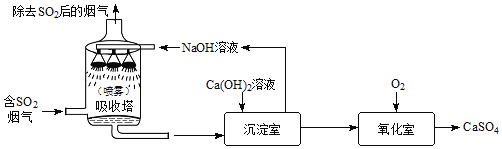
(2)某同学设计了如图所示的实验装置,进行一氧化碳还原氧化铁的实验。

①写出玻璃管内发生反应的化学方程式_____。
②晓晓同学认为该装置有明显不足之处,请指出_____。
(3)在CuSO4和ZnSO4的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,没有气泡产生,则滤出的固体是_____;滤液中一定含有的阳离子是_____(填符号),有关反应的化学方程式为_____。
【答案】硬度大 涂漆 Fe2O3+3CO![]() 2Fe+3CO2 没有处理尾气 铜 Zn2+、Fe2+ Fe+CuSO4═FeSO4+Cu
2Fe+3CO2 没有处理尾气 铜 Zn2+、Fe2+ Fe+CuSO4═FeSO4+Cu
【解析】
(1)钢和纯铁相比,它具有的优越性能主要有硬度大、耐腐蚀等,故填硬度大等;
生铁在潮湿的环境中容易生绣,防锈的措施:涂漆,涂油,镀一层金属等,故填涂漆。
(2)①玻璃管内氧化铁和一氧化碳反应生成铁和二氧化碳,故反应的化学方程式写为:Fe2O3+3CO![]() 2Fe+3CO2。
2Fe+3CO2。
②该装置的明显不足之处:没有处理尾气装置,会造成一氧化碳污染空气,故填没有处理尾气。
(3)铁不能和硫酸锌反应,能和硫酸铜反应生成硫酸亚铁和铜,向滤出的固体中滴加稀硫酸,没有气泡产生,说明固体中不含有铁,则滤出的固体是铜,故填铜;
铁不能和硫酸锌反应,能和硫酸铜反应生成硫酸亚铁和铜,滤液中一定含有的阳离子是锌离子和亚铁离子,锌离子的符号为Zn2+,亚铁离子的符号为Fe2+,故填Zn2+、Fe2+;
铁和硫酸铜反应生成硫酸亚铁和铜,故反应的化学方程式写为:Fe+CuSO4═FeSO4+Cu。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案