题目内容
【题目】酸、碱、盐是有广泛用途的重要化合物,它们的性质、制法等是化学研究的重要内容。
(1)侯德榜先生是我国制碱工业的先驱,请用化学方程式表示“侯氏制碱法”中的如下反应:向饱和食盐水中先后通入足量NH3和CO2,生成小苏打(在该溶液中难溶)和一种氮肥__________。
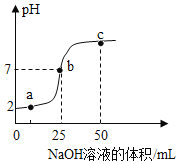
(2)向盛有一定量澄清石灰水的烧杯中,逐滴滴加稀盐酸,用pH传感器测得溶液的pH与加入稀盐酸的关系曲线如图。
①请写出上述反应的化学方程式__________。
②若把原烧杯中澄清石灰水换为等质量、等浓度的氢氧化钠溶液进行该实验,则pH传感器测得的曲线可能经过_________(填“a”、“b”或“c”)点。
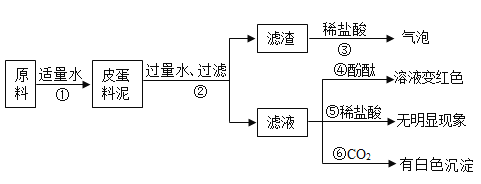
(3)为了除去NaCl溶液中含有少量的CaCl2、MgSO4可溶性杂质,向溶液中先后加入Ba(OH)2、Na2CO3、稀盐酸三种溶液。实验过程如图所示。(提示:微溶物不形成沉淀)。
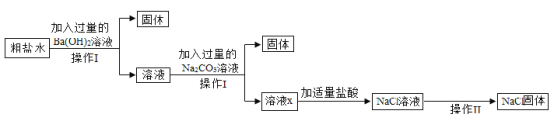
①操作Ⅰ和操作Ⅱ都要用到玻璃棒,在操作Ⅱ中玻璃棒的作用什么__________?
②以上实验过程中所发生的复分解反应共有__________个。
③用实际参加反应的离子符号来表示反应的式子叫做离子方程式,复分解反应的实质就是反应物的离子间结合生成了沉淀、气体或水。请用离子方程式表示Na2CO3与CaCl2反应的实质__________。
④溶液x中除氯化钠之外,还含有碳酸钠和氢氧化钠,请设计实验方案证明__________。(写出实验步骤、现象)。
(4)为测定某纯碱样品(含少量杂质氯化钠)中碳酸钠的质量分数,称取该样品25g,加入到盛有100g稀盐酸的烧杯中,恰好完全反应,反应后称得烧杯中剩余物质的总质量为116.2g。求纯碱样品中碳酸钠的质量分数__________。
【答案】![]()
![]() a 不断搅拌,防止因局部温度过高造成液滴飞溅 5
a 不断搅拌,防止因局部温度过高造成液滴飞溅 5 ![]() 取少量的溶液ⅹ,滴加足量的CaCl2(或BaCl2等)溶液,有白色沉淀产生,静置(或过滤),向上层清液(或滤液)中滴加酚酞溶液,溶液变红 84.8%
取少量的溶液ⅹ,滴加足量的CaCl2(或BaCl2等)溶液,有白色沉淀产生,静置(或过滤),向上层清液(或滤液)中滴加酚酞溶液,溶液变红 84.8%
【解析】
(1)向饱和食盐水中先后通入足量NH3和CO2,生成小苏打(在该溶液中难溶)和一种氮肥,根据质量守恒定律,化学反应前后,元素的种类不变,反应物中含Na、Cl、N、H、C、O,生成物中含Na、H、C、O,故生成物中还应含N、Cl、,故生成的氮肥应是氯化铵,该反应的化学方程式为:![]() ;
;
(2)①氢氧化钙与稀盐酸反应生成氯化钙和水,该反应的化学方程式为:![]() ;
;
②氢氧化钙与稀盐酸:![]() ,设原烧杯中氢氧化钙的质量为m,消耗盐酸的质量为x,氢氧化钙与消耗盐酸的质量比为:(40+34):(2×36.5)=m:x,x=71m/74;氢氧化钠与稀盐酸反应:
,设原烧杯中氢氧化钙的质量为m,消耗盐酸的质量为x,氢氧化钙与消耗盐酸的质量比为:(40+34):(2×36.5)=m:x,x=71m/74;氢氧化钠与稀盐酸反应:![]() ,氢氧化钠的质量与氢氧化钙相同,设mg氢氧化钠消耗盐酸的质量为y,(23+16+1):(35.5+1)=m:y y=71m/80,故若把原烧杯中澄清石灰水换为等质量、等浓度的氢氧化钠溶液进行该实验,氢氧化钠消耗盐酸的质量少,则pH传感器测得的曲线可能经过a点;
,氢氧化钠的质量与氢氧化钙相同,设mg氢氧化钠消耗盐酸的质量为y,(23+16+1):(35.5+1)=m:y y=71m/80,故若把原烧杯中澄清石灰水换为等质量、等浓度的氢氧化钠溶液进行该实验,氢氧化钠消耗盐酸的质量少,则pH传感器测得的曲线可能经过a点;
(3)①由图可知,操作Ⅰ实现了固液分离,故操作Ⅰ是过滤,经过操作Ⅱ,氯化钠溶液变为氯化钠固体,故操作Ⅱ是蒸发,蒸发操作中,玻璃棒的作用是:搅拌,防止局部温度过高,造成液滴飞溅;
②加入过量氢氧化钡,氢氧化钡与硫酸镁反应生成氢氧化镁和硫酸钡,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,属于复分解反应;
加入过量碳酸钠,碳酸钠与氯化钙反应生成碳酸钙和氯化钠,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,属于复分解反应;
碳酸钠与过量的氢氧化钡反应生成碳酸钡和氢氧化钠,符合“两种化合物互相交换成分生成另外两种化合物”的反应,属于复分解反应;
过量的碳酸钠与稀盐酸反应生成氯化钠、二氧化碳和水,符合“两种化合物互相交换成分生成另外两种化合物”的反应,属于复分解反应;
生成的氢氧化钠和稀盐酸反应生成氯化钠和水,符合“两种化合物互相交换成分生成另外两种化合物”的反应,属于复分解反应;
故复分解反应共有5个;
③复分解反应的实质就是反应物的离子间结合生成了沉淀、气体或水,碳酸钠与氯化钙反应生成碳酸钙和氯化钠,故该反应的实质是钙离子和碳酸根离子结合生成碳酸钙沉淀,即![]() ;
;
④碳酸钠能与氯化钙反应生成碳酸钙白色沉淀和氯化钠,故加入过量氯化钙,产生白色沉淀,说明含碳酸钠,过量氯化钙可将碳酸钠除尽,取反应后上层清液,滴加无色酚酞试液,氢氧化钠显碱性,能使无色酚酞试液变红,故溶液变红,说明含氢氧化钠,故填:取少量的溶液ⅹ,滴加足量的CaCl2(或BaCl2等)溶液,有白色沉淀产生,静置(或过滤),向上层清液(或滤液)中滴加酚酞溶液,溶液变红;
(4)碳酸钠与稀盐酸反应生成氯化钠、二氧化碳和水,根据质量守恒定律,化学反应前后,物质的总质量不变,生成二氧化碳的质量为:25g+100g-116.2g=8.8g;
解:设样品中碳酸钠的质量为x
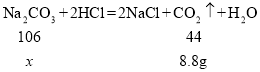
![]()
x=21.2g
样品中碳酸钠的质量分数为:![]()
答:该纯碱样品中碳酸钠的质量分数为84.8%。