题目内容
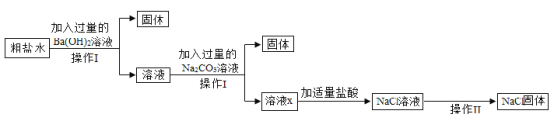
【题目】下列框图中的物质均为初中化学常见的物质,其中A是建筑材料的主要成分,B属于氧化物,F为一种常见的碱溶液,下图是它们之间的相互转化关系。请回答:
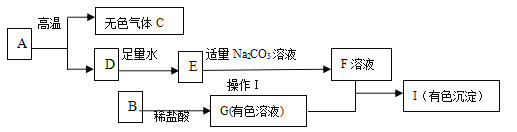
(1)写出下列物质的化学式:A___________ 、E______________。
(2)若I是蓝色色沉淀,请写出G+F![]() I的化学方程式:_______,并指出反应的基本类型:______反应。
I的化学方程式:_______,并指出反应的基本类型:______反应。
(3)若I是红褐色沉淀,则G溶液中应该含有的金属离子是________(用符号表示)
【答案】CaCO3 Ca(OH)2 CuCl2+2NaOH=Cu(OH)2↓+2NaCl 复分解 Fe3+
【解析】
A是建筑材料的主要成分,A是碳酸钙,碳酸钙发生分解反应生成氧化钙、二氧化碳,C是二氧化碳,D是氧化钙。氧化钙与水反应生成氢氧化钙,E是氢氧化钙。Na2CO3+Ca(OH)2 =CaCO3↓+2NaOH,F是氢氧化钠。B属于氧化物,能与稀盐酸反应生成有色溶液G,氢氧化钠与有色溶液G反应生成有色沉淀I,B可以是CuO或Fe2O3,发生的反应是CuO+2HCl=CuCl2+H2O或Fe2O3+6HCl=2FeCl3+3H2O,G是氯化铜或氯化铁,发生的反应是:CuCl2+2NaOH=Cu(OH)2↓+2NaCl或FeCl3+3NaOH=Fe(OH)3↓+3NaCl,I是Cu(OH)2或Fe(OH)3。将推出的各种物质代入转化关系中进行验证,推断正确。
(1)A是CaCO3 、E是Ca(OH)2
(2)若I是蓝色色沉淀,I是Cu(OH)2,G、F分别是CuCl2、NaOH,则G+F→I的化学方程式为:CuCl2+2NaOH=Cu(OH)2↓+2NaCl,两种化合物互相交换成分生成另外两种化合物的反应是复分解反应,该反应是复分解反应。
(3)若I是红褐色沉淀,I是Fe(OH)3,则G是FeCl3,FeCl3溶液中含有的金属离子是Fe3+。