题目内容
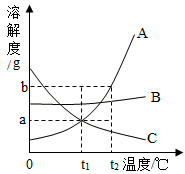
【题目】侯氏制碱法的产物中有碳酸氢钠( NaHCO3)、氯化铵(NH4C1)两种物质,它们的溶解度曲线示意图如下,由此得到的结论正确的是
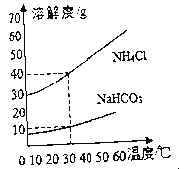
A. 碳酸氢钠的溶解度比氯化铵的溶解度大
B. 30℃时,氯化铵和碳酸氢钠的质量分数不可能相等
C. 30℃时,氯化铵饱和溶液的质量分数为40%
D. 30℃时,将氯化铵饱和溶液降温,有晶体析出
【答案】D
【解析】A、比较溶解度的大小时要限定温度,错误;
B、30℃时,氯化铵和碳酸氢钠的饱和溶液的质量分数不可能相等,对于不饱和溶液完全可能相同,错误;
C、30℃时,氯化铵的溶解度是40g ,故溶质的质量分数为![]() =28.6%,故错误;
=28.6%,故错误;
D、氯化铵的溶解度随温度的升高而升高,故30℃时,将氯化铵饱和溶液降温,有晶体析出,正确。故选D。

【题目】某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸。NaOH和Ca(OH)2的市场价格如表:
名称 | Ca(OH)2 | NaOH |
价格(元/kg) | 6.00 | 24.00 |
(1)若要清洗50kg这种石油产品,需要__________gNaOH?(写出计算步骤)
(2)石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。每处理50kg这种产品,可以节约______________元经费?
【题目】化学实验探究总是能引起同学们的兴趣。某化学兴趣小组在实验室实验时发现了一瓶标签缺损的溶液,如下图。为了确认其溶质成分,同学们进行了如下探究:
(提出猜想)猜想一:NaCl; 猜想二:Na2CO3;猜想三: NaHCO3 猜想四:NaOH
(设计实验一)
小明取少量溶液样品于试管中,用玻璃棒蘸取溶液滴在pH试纸上,读取数据,pH=9,得出结论,猜想四成立。
小王认为小明的结论不准确,理由是:________________。
从小明的实验结果中可以判断出猜想_________也一定是错误的。
(设计实验二)小红取适量稀盐酸于试管中,滴加少量此溶液,溶液中产生气泡。于是认为猜想二正确。
小王认为仍然不能确定,理由是_______________。
(查阅资料)常温下,碳酸钠和碳酸氢钠的溶解度为以下表格中的数据。
Na2CO3 | NaHCO3 | |
溶解度/g | 21.8 | 9.6 |
(分析结论)从资料显示的数据,再结合药品的标签,可以判断猜想_________不正确,理由是_____________________。
(问题交流)(1)Na2CO3和 NaHCO3在生活中被称为“苏打兄弟”,其中NaHCO3在生活中可用来_______________ (写出一条即可)。
(2)Na2CO3在空气中长期放置,会吸收空气中水蒸气和另一种气体而转变成 NaHCO3。请你写出反应方程式________________________。
[注意:若答对以下问题可奖励4分,化学试卷总分不超过60分。]
兴趣小组和老师一起继续实验,将盐酸滴加到Na2CO3溶液中进行反应,并用数字化实验装置pH传感器测定了溶液中pH的变化。采集数据得到曲线如下图所示。
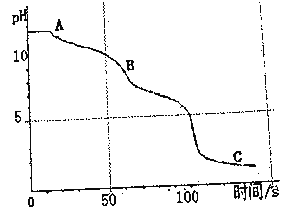
(3)0-50s时,同学们观察到溶液中并没有想象中的气泡产生,请你写出AB段发生反应的化学方程式:__________________。
(4)B点溶液pH大于7,是因为___________(填物质名称)的水溶液呈碱性。
(5)C点所得溶液的溶质是__________________。