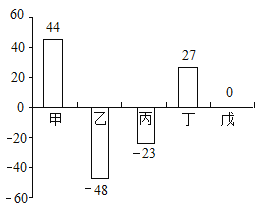
题目内容
【题目】甲烷是一种清洁燃料。某密闭容器中有甲烷(![]() )、氧气和二氧化碳三种物质,在一定条件下充分反应,测得反应前后各物质的质量如表所示。根据表中信息,判断下列说法正确的是( )
)、氧气和二氧化碳三种物质,在一定条件下充分反应,测得反应前后各物质的质量如表所示。根据表中信息,判断下列说法正确的是( )
物质 |
|
|
|
|
反应前质量 | 16 | 70 | 1 | 0 |
反应后质量 | 0 | X | 45 | 36 |
A. 日常燃烧甲烷不会产生温室气体
B. 表中“X”值为6
C. 该反应为分解反应
D. 16g甲烷在50g氧气中燃烧会生成![]()
【答案】BD
【解析】
A. 日常燃烧甲烷会产生二氧化碳,所以会产生温室气体,故不符合题意;
B. 反应后X=16+70+1+0-0-45-36=6,所以表中“X”值为6,故符合题意;
C. 此反应中甲烷、氧气质量减少,二氧化碳和水质量增加,所以不是分解反应,分解反应是一种物质质量减少,多种物质的质量增加,故不符合题意;
D.由题意知,16g的甲烷与(70g-6g)=64g的氧气完全反应生成二氧化碳和水,若 16g甲烷在50g氧气中燃烧因氧气量不足会生成![]() ,故符合题意。故选BD。
,故符合题意。故选BD。

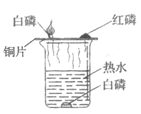
【题目】小明同学设计以下实验来探究可燃物燃烧的条件和测定空气中氧气的含量。(已知白磷的着火点是40℃,红磷的着火点是240℃)
实验装置 | 实验过程 | 实验现象 |
| ①取一烧杯,加入适量的生石灰,再分别取少量白磷、红磷放在烧杯上的铜片上. ②… | 一会儿白磷发生燃烧,红磷不燃烧 |
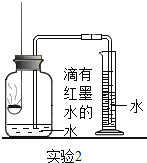
| ③先在容积为350mL的集气瓶中装进50mL滴有红墨水的水,在燃烧匙中放足量白磷,量筒中盛入足量水. ④按图连好仪器,用激光手电照射白磷,白磷燃烧. | 集气瓶和量筒中的水均为红色,量筒内的液体体积减少约60mL |
(1)实验过程②是_____,烧杯中发生反应的化学方程式为_____;
(2)白磷燃烧反应的化学方程式为_____;
(3)根据实验2的结果,计算空气中氧气的体积分数约为_____(写出计算式和结果);
(4)在整个实验2的过程中,集气瓶内的压强变化是_____。
(5)集气瓶中预先装入50mL水,水起的作用是_____。