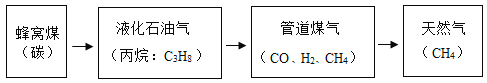
题目内容
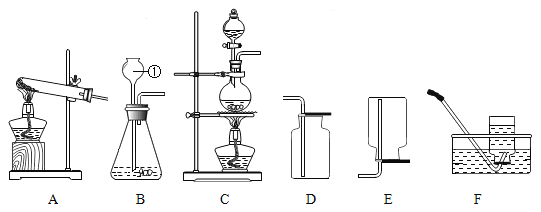
【题目】某小组同学利用如图所示装置探究铁生锈的条件,其中C、D的分液漏斗中为足量且浓度和体积均相同的稀盐酸。
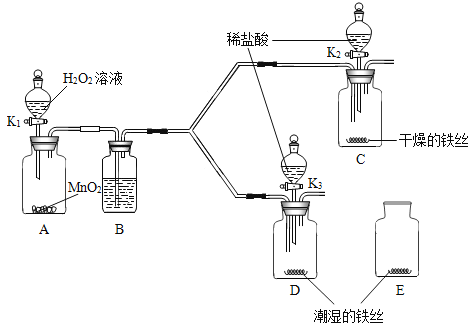
(1)步骤一:关闭K2和K3,打开K1,A中反应的化学方程式是_____,B中所盛放的试剂是_____。对比铁丝表面的变化,能够说明铁生锈与水有关的是装置____和_____(填C、D或E,下同),能够说明铁生锈的快慢与氧气浓度有关的是装置_____和_____。
(2)步骤二:关闭K1,打开K2和K3,将装置C、D中分液漏斗内的稀盐酸同时全部注入广口瓶中,两个广口瓶中现象的不同点是:①_____;②_____,由此也可以判断铁丝生锈情况。C中反应的化学方程式_____。
【答案】2H2O2![]() 2H2O+O2↑ 浓硫酸 C D D E 产生气泡的快慢 溶液的颜色 Fe+2HCl=FeCl2+H2↑
2H2O+O2↑ 浓硫酸 C D D E 产生气泡的快慢 溶液的颜色 Fe+2HCl=FeCl2+H2↑
【解析】
(1)过氧化氢在二氧化锰的催化作用下生成水和氧气,化学方程式为:2H2O2![]() 2H2O+O2↑;该实验中所用氧气应为干燥的氧气,浓硫酸具有吸水性,且不与氧气反应。B中所盛放的试剂是浓硫酸;对比铁丝表面的变化,能够说明铁生锈与水有关可以用干燥和潮湿两种铁丝,故填C和D;铁生锈的快慢与氧气浓度有关的是纯净氧气和空气中的氧气。能够说明铁生锈的快慢与氧气浓度有关的是装置D和E;
2H2O+O2↑;该实验中所用氧气应为干燥的氧气,浓硫酸具有吸水性,且不与氧气反应。B中所盛放的试剂是浓硫酸;对比铁丝表面的变化,能够说明铁生锈与水有关可以用干燥和潮湿两种铁丝,故填C和D;铁生锈的快慢与氧气浓度有关的是纯净氧气和空气中的氧气。能够说明铁生锈的快慢与氧气浓度有关的是装置D和E;
(2)铁单独与氧气接触或与水接触时不容易生锈,与水和氧气同时接触时容易生锈。所以关闭K1,打开K2和K3,将装置C、D中分液漏斗内的稀盐酸同时全部注入广口瓶中,两个广口瓶中现象是:C中有气泡冒出,D中开始没有气泡,过一会有气泡冒出;C中溶液由无色变浅绿色,D中溶液由无色变为黄色。两个广口瓶中现象的不同点是:①产生气泡的快慢;②溶液的颜色;铁和盐酸反应生成氯化亚铁和氢气,化学方程式是:Fe+2HCl=FeCl2+H2↑。

【题目】甲烷是一种清洁燃料。某密闭容器中有甲烷(![]() )、氧气和二氧化碳三种物质,在一定条件下充分反应,测得反应前后各物质的质量如表所示。根据表中信息,判断下列说法正确的是( )
)、氧气和二氧化碳三种物质,在一定条件下充分反应,测得反应前后各物质的质量如表所示。根据表中信息,判断下列说法正确的是( )
物质 |
|
|
|
|
反应前质量 | 16 | 70 | 1 | 0 |
反应后质量 | 0 | X | 45 | 36 |
A. 日常燃烧甲烷不会产生温室气体
B. 表中“X”值为6
C. 该反应为分解反应
D. 16g甲烷在50g氧气中燃烧会生成![]()